View in English?
View in English?
アルツハイマー病 (AD) は世界で最もよく知られる神経変性疾患の一つです。臨床所見には、神経機能障害、細胞内の神経原線維変化、細胞外みられるアミロイド斑 (プラーク) などがあり、神経細胞死が引き起こされます。
アミロイド前駆体タンパク質 (APP) は、ADの発症に関与する100-140 kDa膜貫通型糖タンパク質です。健常者では、APPがαセクレターゼによって切断され、C83カルボキシ末端断片と、正常なシナプス伝達に関与する可溶性APPを産生します。
病態にある場合、APPはまずβセクレターゼによって、続いてγセクレターゼによって異常な切断を受け、アミロイドβ (Aβ) ペプチド、Aβ40およびAβ42が産生されます。Aβは神経毒断片で、オリゴマー形成や凝集が起こり、その結果プラークが形成されます。Aβ40/42の蓄積はイオンチャネル、カルシウムホメオスタシス、ニューロンのエネルギー代謝などを妨害し、最終的には神経細胞死を引き起こします。
また、APPのプロセシングと分泌は、リン酸化の影響を受けることが分かっています。
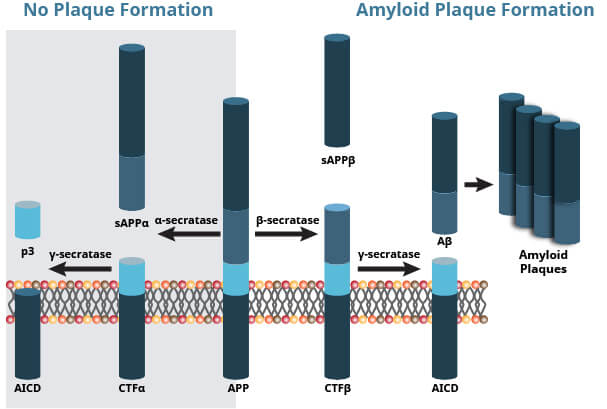
セクレターゼ酵素によるAPPのプロセシング
ADの顕著な特徴には、以下の3つがあります。
上述したAPPの異常なプロセシングと神経毒Aβ断片はまず、Aβがオリゴマーへと凝集し、その後まとまりになって原繊維を形成します。次に、原線維が共にクラスター化し、アミロイド斑 (プラーク) を形成します。このようなプラークはシナプス伝達を妨害し、炎症反応を活性化し、ニューロンの代謝を撹乱します。これらはすべて、神経細胞死に寄与します。
ADにおけるAPPとAβの生理学的および病理学的機能を判断するには、これらタンパク質を正確かつ明確に測定できる方法を持つことが必要です。
Aβの可溶性と量は、ADの症状の判別の目安となります。ヒト脳脊髄液内のAPP存在量は多いですが、Aβの存在量は低くなっています (pmol/L)。従来、APPとAβの発現レベルの測定は、免疫組織化学染色、qPCR、ELISAなどで行われます。
血漿中のAβを検出することは困難ですが、質量分析法やその他の方法により測定技術は進歩しています。Aβペプチドのレベルの変化を検出することは、ADの早期診断やさらには臨床結果を改善に寄与する可能性があります。
最近の研究によると、Aβの蓄積はファゴサイトーシスや小膠細胞 (ミクログリア) によって排除される可能性が示唆されています。さらに、小膠細胞は凝集したAβを梱包し、それにより新しいAβがプラークに付着するのを防ぐことが分かっています。これによってTREM2およびapoEに依存的な神経細胞死が抑制されます。
治療法としては、製薬会社は脳内のAβのレベルを減少させる新しい治療薬の開発に目を向けています。プラークの排除を促進する抗アミロイド免疫療法は、ADの代表的な治療戦略です。