View in English?
View in English?
免疫組織化学染色 (IHC) は、特異的な一次抗体を用いた組織サンプルの細胞タンパク質の標識と、検出試薬を用いた標的の可視化をおこなう手法です。IHCでは、タンパク質発現は、発色または蛍光を検出することで評価することができます。いずれも、一次抗体による抗原認識に依存した検出システムです。蛍光IHCは蛍光色素を用いた直接的または間接的な免疫蛍光染色により、目的抗原の可視化を行います。一方、発色IHCは、酵素反応を利用して抗原の部位に発色剤を沈着させます。
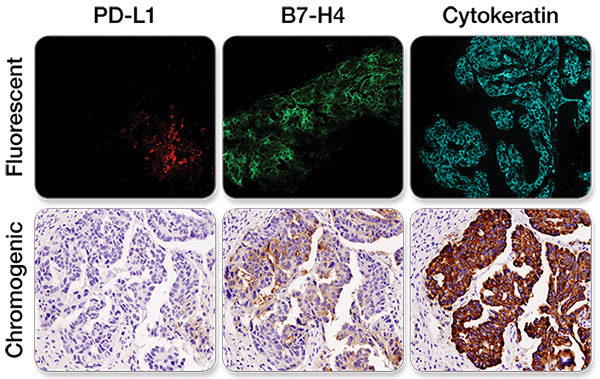
卵巣がんの連続切片を、PD-L1 (E1L3N®) XP® Rabbit mAb #13684 (左)、B7-H4 (D1M8I) XP® Rabbit mAb #14572 (中央)、Pan Keratin (C11) Mouse mAb #4545 (右) で免疫組織化学染色し、蛍光検出および発色検出システムの比較を行いました。注意: 異なる撮像視野の画像を取得しました。
どちらの検出法でも、タンパク質の発現量や、分布については、同程度の情報が得られることが分かります。検出法の選択は、完全にその実験目的に依存します。
IHCは、腫瘍またはその他の組織の悪性病変を形態学的に解析する場合に、一般的に利用されています。IHCでは抗体を利用し、自然な組織の構造や細胞特徴を維持したままタンパク質発現を検出、解析します。
お客様が初めて解析する抗原でも、常に良好な結果が得られるよう、CSTでは、IHCの専門家が数多くの抗体を試験し、IHCに最も適した抗体のみをIHC推奨抗体として販売しています。
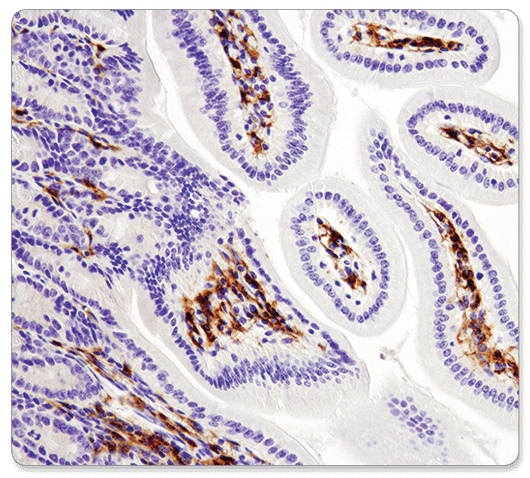
F4/80 (D2S9R) XP® Rabbit mAb #70076 : #70076を使用したパラフィン包埋マウス小腸のIHC解析
CSTでは、IHCの専門家が多くの抗体を試験し、IHCに最適な抗体のみをIHC推奨抗体として販売しています。CSTは、複数の抗原の賦活化法や免疫染色法を試験し、それぞれの抗体について、IHCでの最適使用条件を決定しています。また、抗原の検出感度を高め、IHCプロトコールを効率化するために、関連製品の開発も行なっています。
サンプルの固定操作で形成された架橋構造により、抗原-抗体の結合が阻害されることがあります。 抗原の賦活化は、この架橋構造を取り除く、重要な操作です。抗原の賦活化は、熱処理や、酵素消化によって行います。CSTが推奨する、それぞれの抗体に適した方法は、製品のデータシートに記載されています。
一次抗体は、あらゆるIHCアッセイで重要な試薬で、データの質に直接影響を及ぼします。質の良くない一次抗体を使用した場合、解釈不能な結果が得られたり、誤った結論が導き出されるおそれがあります。抗体がIHCで使用できるかどうかを確認するには、1つの組織サンプルでポジティブ染色を得るだけでは不十分です。抗体が標的を正確に検出ことを確認するためには、厳正な検証が必要となります。
抗体に最適な試薬とプロトコールを使用することで、結果が大きく改善します。
また、検出しているシグナルが特異的であることを確認する必要もあります。あらゆる実験において、適切なコントロールをとることは、非常に重要です。ポジティブコントロールとネガティブコントロールをとることで、抗体が目的の標的のみを検出していることを明らかできます。
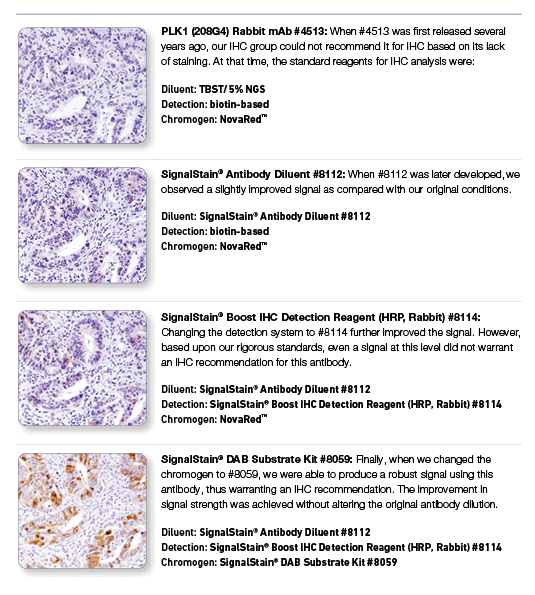
PLK1 (208G4) Rabbit mAb #4513: #4513を用いたパラフィン包埋ヒト結腸がん組織のIHC解析において、図に示した通り、段階的な試薬の変更によってIHCの結果に大きな差が生じることが示されました。
IHC染色が適切に得られない場合に、染色条件を少し変更するだけで解決できる事がよくあります。抗原の賦活化など、プロトコール内のキーステップを改変することで、多くの場合、低シグナルや、高バックグラウンドなどの一般的な問題は解決します。
また、CSTの熟練のテクニカルサポートチームにお問い合わせいただくことで、以下のようなサポートを行うご用意があります。
一次抗体は、あらゆるIHCアッセイで重要な試薬で、データの質に直接影響を及ぼします。また、IHC解析による標的の特異性の決定には、複数の検証ステップが必要です。CSTは、ホルマリン固定したパラフィン包埋 (FFPE) 組織のIHCでご利用いただける、厳格に検証されたリコンビナントモノクローナル抗体を700種以上提供しています。全ての検証を自社で行なっているため、CSTの科学者は、専門的なアドバイスを行い、お客様の時間の節約や、結果の入手のお手伝いをすることができます。広範囲の検証を行い、CSTの全てのIHC-P検証済み抗体が蛍光マルチプレックスIHCに利用できることも確認しています。
CSTの科学者は、抗体の検証に必要な、様々な方法で試験を行い、それぞれのIHC推奨抗体で、特異的な染色像が観察できることを確認しています。検証手順は以下の通りです。
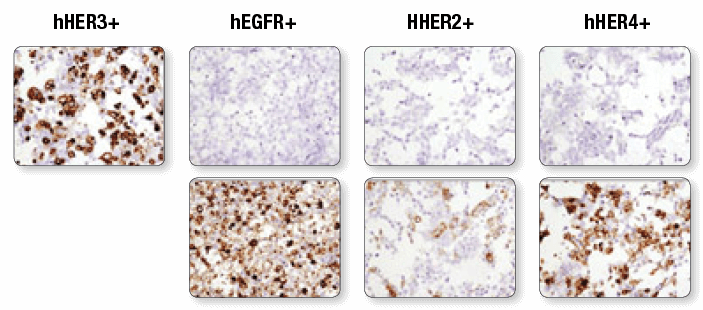
HER3/ErbB3 (D22C5) XP®Rabbit mAb #12708 (上パネル) を用いて、ヒトErbBファミリーメンバーであるHER3、EGFR、HER2、HER4をそれぞれトランスフェクションした、パラフィン包埋293T細胞ペレットを免疫組織化学染色しました。EGF Receptor (D38B1) XP® Rabbit mAb #4267 (下段左)、HER2/ErbB2 (D8F12) XP® Rabbit mAb #4290 (下段中央)、 HER4/ErbB4 (111B2) Rabbit mAb #4795 (下段右) による染色で、トランスフェクションの確認を行いました。
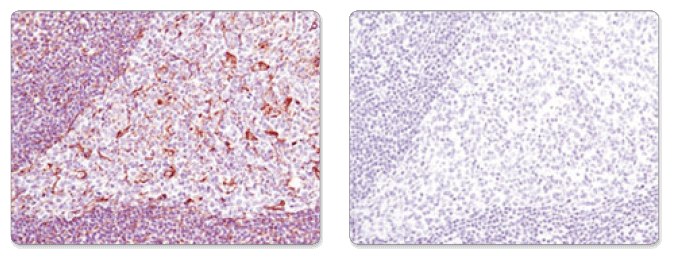
Vimentin (D21H3) XP® Rabbit mAb #5741を用いて、パラフィン包埋ヒト扁桃組織を、コントロールペプチド (左) もしくは抗原特異的ペプチド (右) 存在下で、免疫組織化学染色しました。
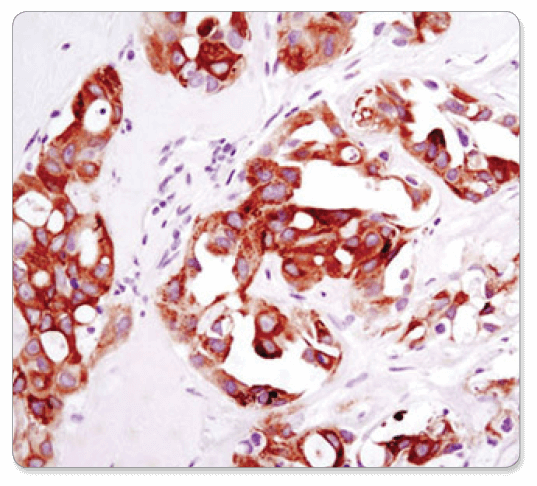
#3287を用いて、HCC78異種移植片を免疫組織化学染色しました。
抗体は実験の成功を左右する要素の一つであり、抗体に最適な試薬とプロトコールを使用することで、結果が大きく改善します。CSTの科学者は、それぞれの抗体の最適条件を設定するため、抗原の賦活化や免疫染色を複数の方法で試験しています。これによって、効率の良いIHCプロトコールの開発や、アッセイの成功のお手伝いをします。CSTでは、抗原の検出を促進し、結果を改善するための関連試薬を開発しています。
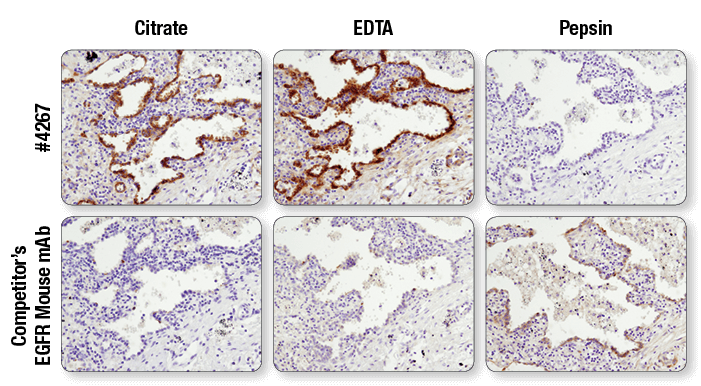
同一タンパク質を標的にする抗体でも、適する抗原賦活化方法が異なる可能性があります。クエン酸バッファーで煮沸 (左)、EDTAバッファーで煮沸 (中央)、またはペプシンで消化 (右) して抗原を賦活化したパラフィン包埋ヒト肺がん組織を、CSTのEGF Receptor (D38B1) XP® Rabbit mAb #4267または他社のEGFR mouse mAbを用いてIHCで解析しました。#4267ではEDTAで賦活化した場合により良好なシグナルが得らますが、他社のEGFR mouse mAbではペプシンで消化した場合にのみシグナルを検出しています。