View in English?
View in English?
細胞生存能力とは、集団内の健康な生細胞の比率を測定したものです。細胞生存能力アッセイは、細胞の全体的な健康状態の判断、培養や実験の条件を最適化する際に行われます。また、薬剤スクリーニングの際には、化合物処理による細胞毒性 (細胞の生存率) を測定するために利用されます。
一般的に、細胞生存能力は、代謝活性、ATP含量、細胞増殖を指標に測定します。また、細胞膜の破綻などの細胞死のマーカーを利用した細胞毒性試験から、細胞の生存能力を評価することもできます。
細胞生存能力アッセイ、細胞毒性アッセイは共に、目的の実験化合物の細胞への効果を評価する重要な実験ツールです。
細胞増殖アッセイは細胞分割事象を直接測定する (細胞を数える) か、DNA含量など細胞分割/DNA複製のマーカーを使います。
細胞増殖とは、細胞周期の最終段階として起こる細胞分裂 (細胞質分裂) により細胞数が増えることを指します。健康な細胞は盛んに増殖するのに対し、増殖が停止した (growth-arrested) 細胞、老化した細胞、死細胞または死につつある細胞は増殖しません。したがって、細胞増殖は、サンプル中の盛んに分裂している細胞数を反映しており、細胞の生存率、生存能力の有用な指標となります。
一般的に、細胞増殖は、複製している細胞内のDNA含量またはDNAの合成を指標に測定します。細胞増殖アッセイは標準的なELISA (enzyme-linked immunosorbent assay)、フローサイトメトリー、免疫蛍光染色、ハイコンテントイメージングなどの手法を利用して行われます。
細胞周期アッセイ:DNA含量の解析
細胞周期アッセイは、細胞周期の異なるステージ (G1、S、G2、M期) にある細胞の比率をフローサイトメトリーで解析する手法です。細胞周期の進行に伴い細胞は大きさが増大し (G1期)、その後DNAの合成と複製が起こり (S期)、さらなる増大 (G2期) を経て、最後に有糸分裂と細胞分裂 (M期) が起こります。細胞周期から外れて増殖を停止した状態 (G0期) を、休止期と呼びます。
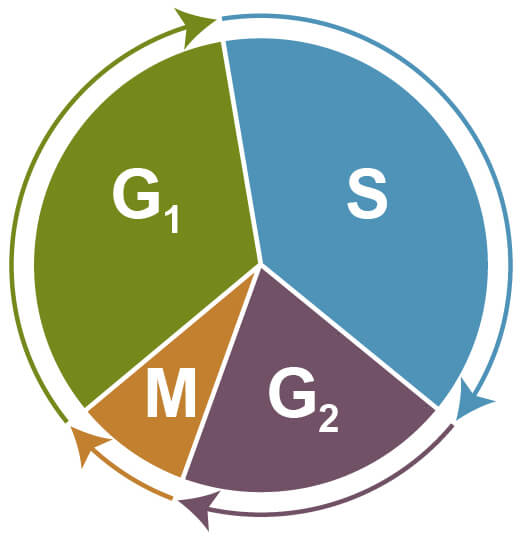
細胞周期 G1期:大きさの増大、S期:DNAの合成と複製、G2期:大きさの増大、M期:有糸分裂と細胞分裂、G0期:休止。
細胞周期アッセイでは、細胞を固定、透過化した後、ヨウ化プロピジウム (PI) などの蛍光色素でDNAを染色し、フローサイトメトリーで解析します。PIの蛍光強度 (1細胞当たりのDNA含有量) は、細胞周期の異なるステージを反映しています。例えば、G2期からM期の細胞のDNA含有量は、G0期またはG1期のものの2倍になりますが、この増加はPIの蛍光強度に反映されます。S期の細胞の蛍光強度はDNA複製の進行に伴って増加し、G0/G1期とG2/M期の細胞で観察される強度の間になります。G0/G1ピークより弱い蛍光強度をもつ細胞は、一般的にDNAが断片化したアポトーシス細胞です。
増殖アッセイ:DNA合成の解析
トリチウムラベルしたチミジンや、5-ブロモ-2'-デオキシウリジン (BrdU) などの存在下でS期を通過した細胞は、複製されたDNAにこれらの標識ヌクレオチドを取り込みます。これらの標識の取り込みの度合いが、解析対象の細胞集団に含まれる増殖中の細胞数を反映します。トリチウムラベルしたチミジン取り込みを解析する場合は、放射性同位体を使用することになります。一方、BrdUの取り込みは、抗BrdU抗体を用いることでELISA、フローサイトメトリー、IF-ICなどで検出することができ、放射線同位体は使用しません。
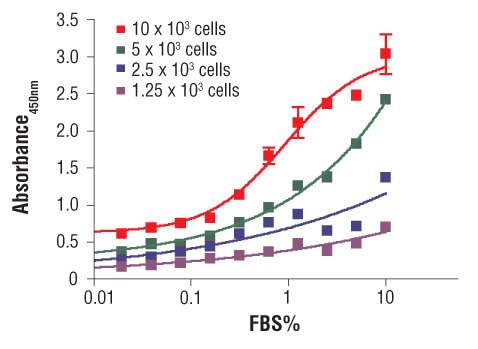
96ウェルプレートに異なる密度のC2C12細胞を播種し、無血清培地で一晩インキュベートしました。その後、異なる濃度の血清で増殖を刺激し、さらに24時間細胞をインキュベートしました。最後に10 μM BrdUをプレートに添加して4時間インキュベートした後、BrdUの取り込みを解析しました。
細胞増殖のマーカータンパク質の検出
分裂している細胞は、休止期の細胞や老化細胞に比べ細胞周期タンパク質の発現が多く、これらを指標として増殖中の細胞を検出することができます。細胞増殖の指標としてよく用いられるものに、PCNA (proliferating cell nuclear antigen)、Ki67、リン酸化ヒストンH3などがあり、これらはウェスタンブロット (WB)、IF、IHC、フローサイトメトリー、ELISAなどで検出することができます。
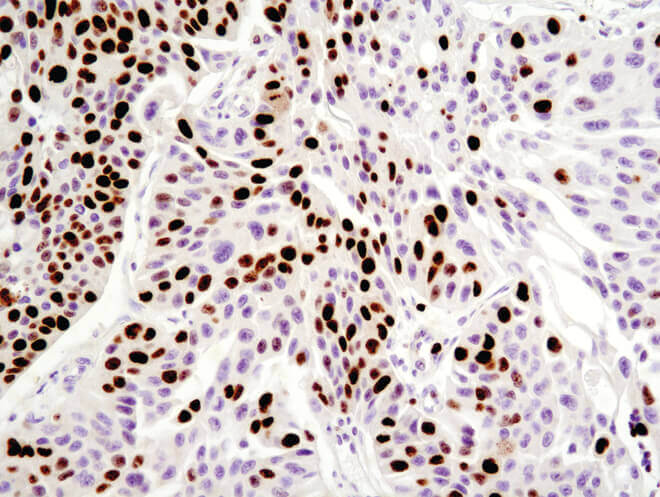
パラフィン包埋ヒト乳がんをKi-67 (8D5) Mouse mAbを用いて免疫組織化学染色で解析しました。
細胞老化 (細胞増殖停止の指標として)
複製過程の異常が細胞老化の原因になることがあります。老化した細胞は増殖を止め、増殖刺激に応答しなくなります。したがって、細胞増殖アッセイを補完するものとして、細胞老化のマーカーを利用できることがあります。細胞老化の特徴として、細胞の大きさの拡大、pH依存性β-ガラクトシダーゼ活性の亢進、遺伝子発現のパターン変化などがあり、これらを併せて細胞増殖アッセイの結果を考察します。
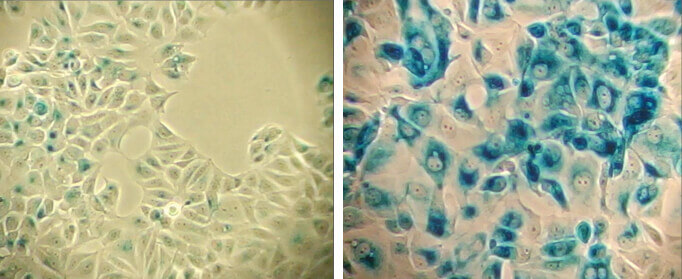
Etoposide #2200 (12.5 μM、24時間) 処理後、4日間培養することで老化を誘導したMCF-7細胞 (右) と、未処理コントロール細胞 (左) の、β-ガラクトシダーゼ (pH6.0) 染色。
細胞生存能力アッセイは、サンプル内の健康な細胞数を判断するために使用します。上記の増殖アッセイを除き、細胞生存能力アッセイは細胞分裂の有無を区別することなく、集団の全体的な健康状態を解析します。
細胞生存能力の一般的な指標として、ヨウ化プロピジウムなどの色素 (生存状態に依存して細胞を染色する色素) による染色パターンのほか、代謝活性やATP含量などが挙げられます。
MTTアッセイやXTTアッセイなどの代謝アッセイは、ミトコンドリア酵素による呈色基質の還元反応を定量解析することで、細胞の健康状態の指標とします。MTTアッセイは、この指標をもとに生存細胞の相対数を定量化します。黄色のテトラゾリウム色素MTT (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide) を培養液に加えて細胞をインキュベートします。MTTは健康な細胞ではミトコンドリア酵素に還元されて紫色の不溶性ホルマザン産物が産生されます。これを界面活性剤またはイソプロパノールで可溶化した後、マイクロプレートリーダーで吸光度 (450 nm) を測定することで、生存細胞数を測定します。XTTアッセイはMTTアッセイの変法で、可溶性のホルマザン産物を産生するため、可溶化ステップを必要としません。
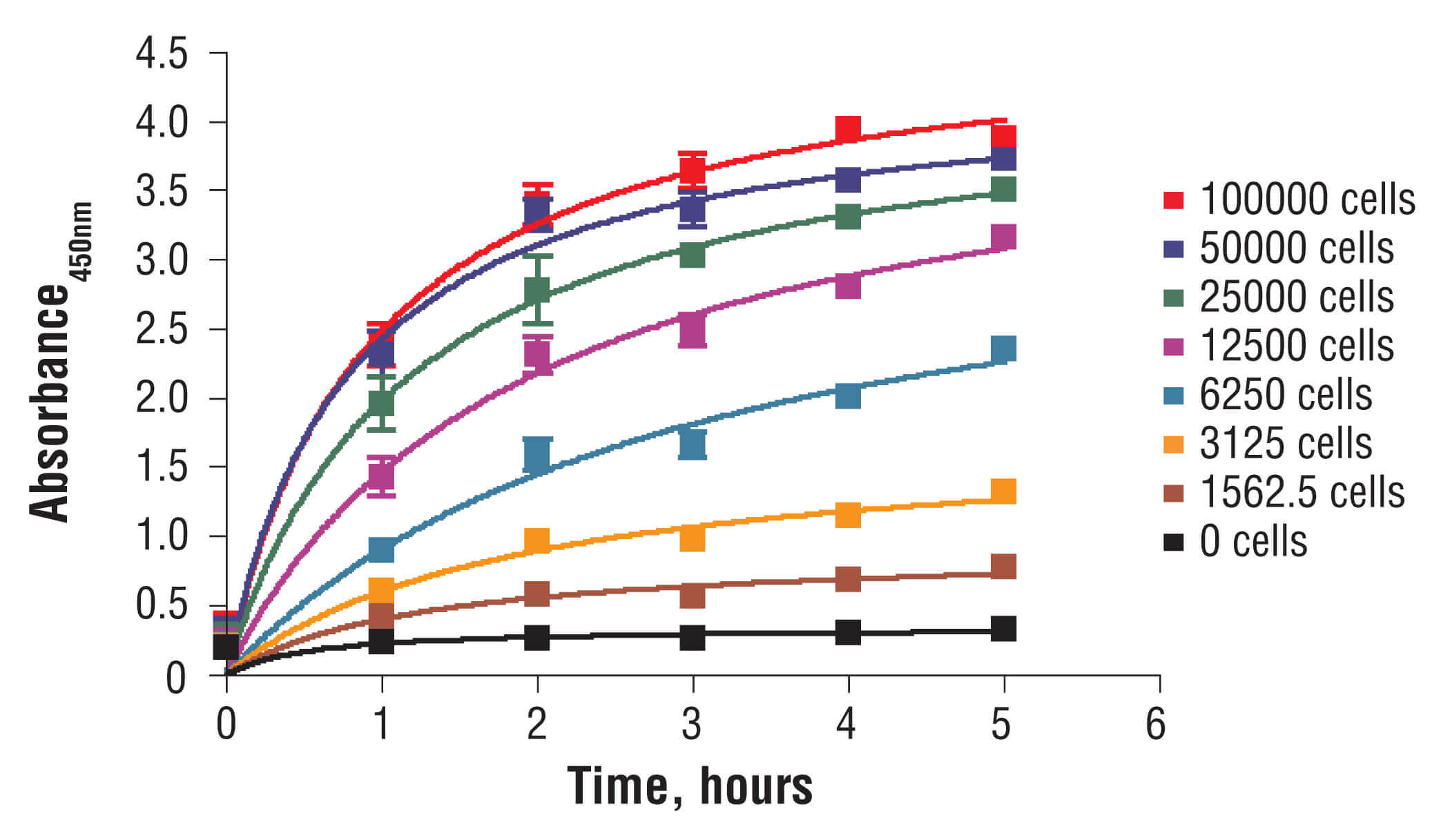
96ウェルプレートに異なる密度のC2C12細胞を播種し、一晩インキュベートしました。XTTアッセイ溶液をプレートに添加し、細胞をインキュベートしました。1.0、2.0、3.0、4.0、5.0時間後に450 nmの吸光度を測定しました。
ATP測定アッセイは、ATP含量を代謝的に活性な細胞数の指標として、サンプル内の生存細胞の数を測定するものです。これらアッセイは、マルチウェルプレート上でATP要求性の生化学反応を行い、その活性を比色、蛍光、あるいは化学発光発光として検出、定量します。この方法は、ATPを産生する活性を持ったミトコンドリアを保持する生存細胞の数を測定することになります。
細胞毒性は、物質が細胞を傷害したり死滅させる能力を指します。細胞毒性は、細胞膜の完全性の損失など、細胞死のマーカーを定量化するアッセイにより直接評価することができます。細胞毒性は、上記の細胞生存能力アッセイを使って間接的に評価することもできます。
細胞毒性アッセイは薬理作用のある物質による処理や、その他のストレスに応答した細胞の生存を評価に用いることができます。また、免疫細胞による腫瘍細胞の傷害に化合物が及ぼす影響を評価するT細胞キリングアッセイは、がん免疫の研究分野で有力な研究ツールとなっています。
細胞毒性は、物質が細胞を傷害したり死滅させる能力を指します。
様々な細胞死や細胞の健康の侵害などを指標とした細胞毒性アッセイがあります。
生細胞と死細胞カウントは、サンプル集団内の生細胞と死細胞の両方を測定できます。代表例として、細胞のトリパンブルー色素の排出能力を観察する方法があります。細胞膜が損傷を受けている死細胞、または死につつある細胞のみがトリパンブルーを取り込み、染色されるため、血球計算盤で死細胞 (青色) および生細胞 (無色) をカウントすることができます。
細胞膜の完全性は、一次性ネクローシスまたはアポトーシス開始後の二次性ネクローシスによる、細胞膜の損傷または破裂を評価します。膜が損傷を受けると、乳酸脱水素酵素 (LDH) など細胞質の内容物が細胞外空間に放出されます。細胞外に放出されたLDHは、比色解析で定量可能で、細胞外LDH量が間接的に障害を受けた細胞や死細胞の数を反映します。細胞膜の完全性は、ヨウ化プロピジウムなど膜非透過性の色素の取り込みを解析することによっても評価できます。
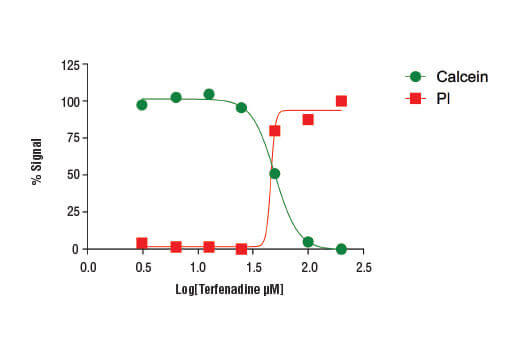
テルフェナジンで4時間処理したHeLa細胞 (4 x104細胞/ウェル) をCell Health Assay Kitで解析しました。テルフェナジンの用量依存的に細胞の生存能力が減少する様子が分かります。
T細胞キリングアッセイは、免疫細胞による培養がん細胞の傷害を評価するアッセイで、試験化合物の効果をテストするために利用されます。細胞傷害性T細胞は、ウイルスに感染した細胞や腫瘍細胞を認識して傷害するT細胞の一種です。T細胞キリングアッセイでは、標的腫瘍細胞をまず生細胞と死細胞の区別をするレポーターで標識します。その後試験化合物と細胞傷害性T細胞を培地に添加し、細胞のライブイメージングかフローサイトメトリーを利用して、腫瘍細胞の生存能力をモニターします。
アポトーシスは、多細胞生物の正常な成長、発生、恒常性維持に必要なプログラムされた細胞死ですが、細胞のストレス応答として起こることもあります。これはネクローシス、ネクロプトーシス、そしてパイロトーシスとは区別される細胞死機構です。アポトーシスを起こした細胞では、特徴的な細胞の収縮、膜ブレブ形成、核の断片化およびクロマチン凝縮がみられます。細胞の残骸はアポトーシス小体となり、食細胞に貪食されます。
アポトーシスには、カスパーゼと呼ばれるタンパク質分解酵素の一種が関与します。カスパーゼは大きく分けて、内因性経路 (ミトコンドリア膜電位の喪失とシトクロムcの細胞質への放出)、外因性経路 (デスレセプターへのリガンドの結合) の2種類のアポトーシスシグナル伝達機構によって活性化されます。アポトーシスの経路と制御に関する詳しい情報は、こちらからご覧ください。
アポトーシスは通常、個体の発生と成長の段階で不要となった細胞を除去するために起こります。また、ウイルスに感染した細胞やDNA損傷を受けた細胞など、個体にとって害になりうる細胞もアポトーシスによって除去されます。様々な疾患でアポトーシス調節機構の異常がみられ、自己免疫疾患や神経変性疾患などでアポトーシスの亢進、様々ながんでアポトーシスの抑制が起こることが知られています。
実験室レベルでは、細胞をTNF-R1、TNF-R2といった細胞死受容体 (デスレセプター) のリガンドや、StaurosporineやEtoposideといった化合物で処理することで、アポトーシスを誘導することができます。
アポトーシスは厳密に制御されたプログラム細胞死の一種です。これに対して、ネクローシスはプログラムされていない細胞死と言われ、突発的な細胞傷害や感染によって起こります。ネクローシスを起こした細胞では、細胞質や細胞小器官が腫脹し、膜の完全性が失われ、最終的には細胞溶解が起こって細胞内容物が細胞外空間に放出されます。ネクローシスは周辺領域の炎症性反応を誘導しますが、アポトーシスは炎症反応を誘導しません。また、アポトーシス経路を辿っていた細胞の一部に、途中からネクローシス様の特徴示す細胞があり、これを二次性ネクローシスと呼びます。
ネクローシスは通常、プログラムされていない細胞死と考えられていますが、制御されたネクローシスとして、ネクロプトーシスが報告されています。ネクロプトーシスは、アポトーシス機構を阻害するウイルスに感染した細胞で、カスパーゼ非依存的に細胞死を誘導することで、ウイルス感染に対する防御機構として機能します。この経路は、炎症促進性シグナル伝達や虚血性傷害によっても活性化されます。
パイロトーシスは、一般に免疫細胞で見られる微生物やウイルス感染に応答したカスパーゼ-1による溶解性の細胞死です。
アポトーシスアッセイでは、アポトーシスを起こした細胞数を定量化します。代表的な指標として、細胞膜外側へのアネキシンVの結合、カスパーゼの活性化、クロマチン凝縮、DNA断片化、またはシトクロムcの放出などがあります。
Annexin Vアッセイ
アポトーシスを起こした細胞では、細胞膜の不均一性が失われ、本来リン脂質二重層の細胞内側に配置されるホスファチジルセリン (PS) が細胞外側に露出するようになります。PSが細胞外側に露出することで、食細胞による貪食が促進されます。蛍光標識したアネキシンVで細胞表面に露出したPSを特異的に認識し、細胞をラベルすることで、フローサイトメトリー、IF、ELISAでアポトーシス細胞を検出することができます。これはアポトーシスの早期マーカーとして広く利用されています。
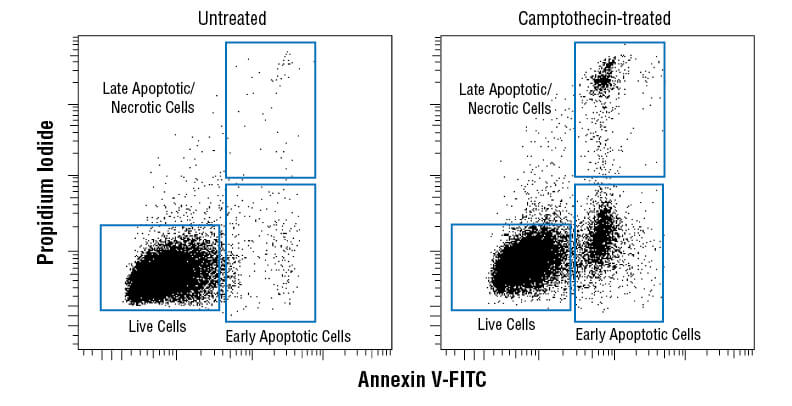
Annexin V-FITC Early Apoptosis Detection Kitを用い、Camptothecin処理 (10 μM、4時間) したJurkat細胞 (右) と未処理コントロール細胞をフローサイトメトリーで解析しました。
カスパーゼアッセイ
カスパーゼはアポトーシスの開始や実行に当たって活性化するプロテアーゼで、不活性型の前駆体酵素が切断を受け、活性型断片が切り出されます。カスパーゼ-8と9はアポトーシスの開始に当たって活性化される誘導型カスパーゼ (initiator caspase) で、カスパーゼ-3などの実行型カスパーゼ (executer/effector caspase) を切断し、活性化します。カスパーゼ-3の切断はアポトーシスの指標として利用することができ、ウェスタンブロッティング、IF、IHC、フローサイトメトリーで検出することができます。カスパーゼ-3の酵素活性は、蛍光基質を利用したアッセイで測定することもできます。また、カスパーゼによって切断されたPARPなどの基質を切断型カスパーゼ-3と同様の方法で検出することもでき、切断されたカスパーゼ基質の量がサンプル中に含まれるアポトーシスを起こした細胞数を反映すると考えることができます。アポトーシスの経路は、その他の活性型カスパーゼを認識する抗体を使用することで、さらに解析することもできます。
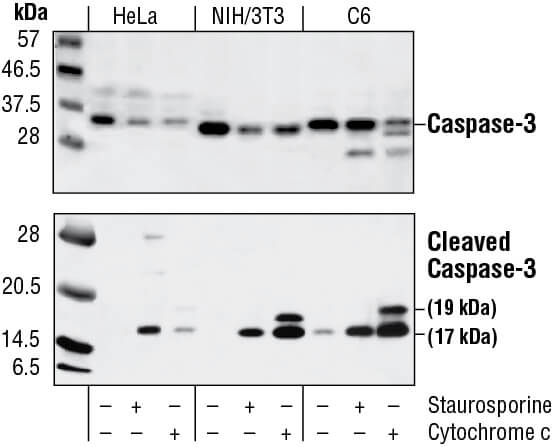
HeLa、NIH/3T3、C6細胞についてウェスタンブロットでカスパーゼ-3 (全長および活性型) の解析を行いました。培養中にStaurosporine処理 (3時間、1 µM) した細胞と未処理コントロール細胞の抽出物、 細胞抽出物を試験管内でシトクロムc処理 (1時間、0.25 mg/mL) したものをそれぞれ調製し、Caspase-3 Antibody (上)、Cleaved Caspase-3 (Asp 175) Antibody (下) で解析しました。
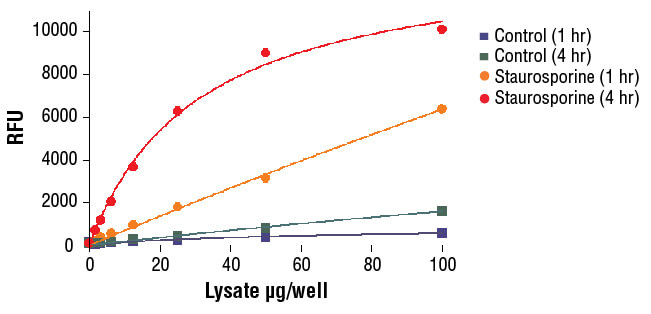
Caspase-3 Activity Assay Kit #5723を用い、NIH/3T3細胞のカスパーゼ-3の酵素活性を検出しました。Staurosporine #9953で処理 (5 μM、5時間) した細胞をPathScan® Sandwich ELISA Lysis Buffer (1X) #7018 (キットに同梱) で溶解し、アッセイに用いました。
クロマチンの凝縮
アポトーシスの形態的特徴として、核の不均一な複合体であるクロマチンがコンパクトに凝集することが古くから知られています。クロマチン凝縮は、核を染色することでIFやフローサイトメトリーで観察することができます。核染色色素で染色すると、アポトーシスを起こした細胞は凝縮したクロマチンのため蛍光シグナルがより強くなります。
TUNELアッセイ
DNA鎖崩壊とDNA断片化はアポトーシス後期の特徴で、TUNELアッセイ (TdT dUTP nick end labeling assay、TdT:terminal deoxynucleotidyl transferase) で検出することができます。これによって、サンプルの細胞集団中のアポトーシスを起こした細胞数をIF、IHC、プレートリーダーによる読み取り、フローサイトメトリーなどで定量化することができます。TdT酵素は、DNA二本鎖断裂で露出したDNA末端に、蛍光色素やビオチンで標識したdUTPを付加することができます。アポトーシスを起こした細胞やDNA損傷を受けた細胞が修飾dUTPで標識されますが、正常な細胞は標識されません。アポトーシスで断片化されたDNAは、標準的な電気泳動で検出することもできます。正常な細胞の無傷なDNAに対し、アポトーシスを起こした細胞では断片化したDNAのラダーが観察されます。
シトクロムc放出アッセイ
アポトーシスの刺激によって、シトクロムcがミトコンドリアから細胞質へ放出されます。細胞分画によって細胞質とミトコンドリアを分離し、シトクロムcに特異的な抗体でウェスタンブロット解析することができます。
ネクローシスの主な特徴に、細胞膜の破綻と、それに起因する細胞内容物の細胞外空間への放出が挙げられます。これはHMGB1、LDH、IL-1βなどの細胞内/分泌マーカーを利用することで検出できます。
ネクロプトーシスは遺伝子的にプログラムされたのネクローシスで、RIP、RIP3キナーゼを含むネクロソーム複合体の形成が大きな特徴です。ネクロソーム構成タンパク質やネクロプトーシス関連タンパク質 (MLK1など) の発現や翻訳後修飾 (PTM) を測定することで、ネクロプトーシスの解析をすることができます。
微生物感染に応答してインフラマソームが形成され、カスパーゼ-1に依存的なパイロトーシスが開始されます。カスパーゼ-1による切断により、炎症性サイトカインIL-1βやIL-18が活性化されます。カスパーゼ-1はGasdermin Dの切断も行います。この結果、Gasdermin DのN末端断片が多量体化して膜に孔が形成され、IL-1β、IL-18などのDAMPと呼ばれる分子群が細胞から分泌されるようになります。
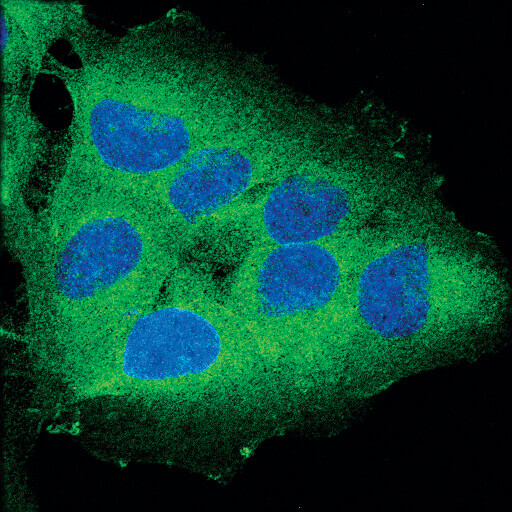
RIP (D94C12) XP® Rabbit mAbを用いてOVCAR8細胞を染色し (緑)、共焦点顕微鏡で解析しました。DRAQ5® #4084を用いてDNAを染色し、青の疑似カラーで示しました。
細胞生存率を測定する場合、実験の目的や条件、解析対象の細胞集団など様々な要因によって最適なアッセイが異なってきます。実験の結果を確認するために、複数の独立したアッセイが必要な場合もあります。
細胞生存率の評価に最良の方法を選択するための検討事項
細胞の種類:解析対象が分裂増殖している細胞の場合は、細胞増殖、代謝活性、細胞膜の完全性を指標に生存解析をすることができます。有糸分裂を終えた細胞、分裂増殖していない細胞が解析対象の場合 (ニューロンなど)、代謝または膜の完全性を指標とした解析が最良の選択となります。細胞の伝播密度、培養条件を標準化することが最適かつ再現性の高い実験結果を得るために重要です。
タイミング:実験的処理 (薬剤処理など) の継続時間が細胞の生存に影響することがあるので、細胞毒性アッセイ、生存能力アッセイを選択する場合は解析のタイミングを十分に検討する必要があります。また、PSの細胞外への露出 (アポトーシス初期) やDNAの断片化 (アポトーシス後期) など、 細胞死のマーカーには特定の段階のみで検出できるものもあります。
細胞死の機構:標準的な細胞生存能力と細胞毒性アッセイからは、解析対象の細胞の生死について定量的なデータが得られる一方、細胞死の原因やメカニズムに関する情報は得られません。細胞死のメカニズムを正しく特定するためには、細胞死経路 (アポトーシスなど) に特異的なアッセイで検討する必要があります。
実験結果の解釈:実験的処理 (薬剤処理など) が細胞の代謝や増殖を直接的に変化させ、細胞死を誘導しないこともあり、生存能力の低下という誤った解釈をもたらす場合もあります。このような危険性を減らすため、これら複数細胞生存能力と細胞毒性アッセイを組み合わせて利用することが重要になります。
多くの場合、細胞生存能力アッセイは、細胞の増殖または代謝活性を指標として、間接的に細胞の健康状態の情報を得ます。フローサイトメトリーでは、解析対象に含まれる生細胞と死細胞を直接的に判定することができます。通常、ヨウ化プロピジウムなど膜非透過性色素で膜に損傷のある死細胞を標識し、カルセイン-AMなどの生細胞染色色素で生細胞を標識します。

テルフェナジンで4時間処理したHeLa細胞 (4 x104細胞/ウェル) をCell Health Assay Kitで解析しました。テルフェナジンの用量依存的に細胞の生存能力が減少する様子が分かります。
免疫組織化学染色 (IHC) は、組織サンプル内で特異的な抗原を発現する細胞集団を検出するために抗体を使用します。この方法は一般的に、発生段階の特定の時期におけるタンパク質発現の分布を特定したり、疾患組織と正常組織におけるタンパク質発現を解析して対比したり、バイオマーカーの発現に基づいて個々の細胞の種類を区別したりするために利用されます。IHCは、組織サンプルに含まれる細胞の生存を判定するために利用することもできます。例えば、Ki67やPCNAなど増殖細胞のマーカーを発現する細胞をカウントし、定量化することで、細胞生存能力を評価することができます。腫瘍細胞の増殖に対する治療の効果を判定するときによく利用される方法です。組織サンプル中のアポトーシスを起こした細胞は、TUNELアッセイのほか、切断型カスパーゼ-3や切断されたPARPに特異的な抗体を用いたIHCで同定することができます。
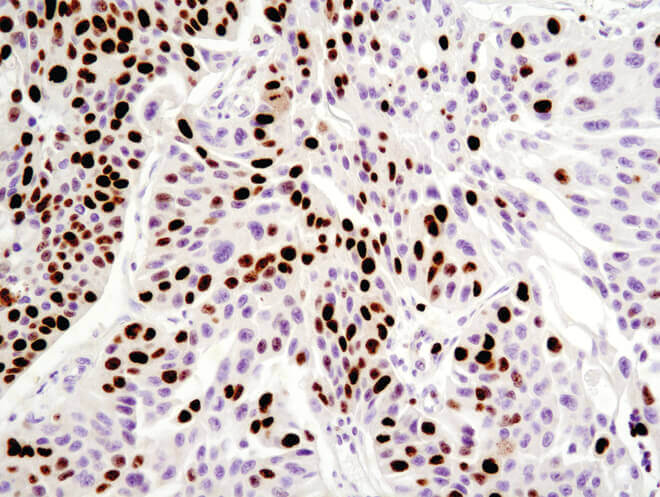
Ki-67 (8D5) Mouse mAbを用いたパラフィン包埋ヒト漿液性卵巣がんの免疫組織化学染色解析。