View in English?
View in English?
エピジェネティクスの多様なプロセスがタンパク質-DNA相互作用を介して制御されています。このような相互作用を研究する場合、これら相互作用がいつ、ゲノムのどこで起こるかを解析する信頼性の高い手法が必要になります。ChIPは、特定の遺伝子や制御領域とタンパク質の相互作用を解析する手法として広く利用されています。ChIPを定量的PCR (qPCR) と組み合わせることで、生細胞内でリアルタイムに起こるタンパク質-DNA相互作用を定量的に解析することができます。これは比較的短時間で実施が可能な、強力な研究ツールとなります。
ChIP-qPCR実験を成功させるには、感度と特異性が高く、再現性の高い結果が得られる抗体を用いることが重要です。CSTのChIP-qPCR検証済み抗体は、信頼性の高いデータを得られるように厳格な検証が実施されています。
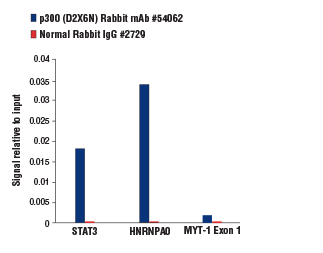
p300 (D2X6N) Rabbit mAb #54062およびNormal Rabbit IgG #2729によるK-562細胞のクロマチン免疫沈降 (ChIP) を行いました。クロマチンサンプルの調製、ChIPプロセスにはSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を用いました。ヒトSTAT3プロモーター、SimpleChIP® Human HNRNPA0 Promoter Primers #83602、SimpleChIP® Human MYT-1 Exon 1 Primers #4493のプライマーセットでリアルタイムPCRを行い、ChIPで濃縮されたDNAを定量解析しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。p300 (D2X6N) Rabbit mAbは、MYT-1 Exon 1 (既知非結合遺伝子領域) と比較し、STAT3およびHNRNPA0領域を8倍以上濃縮しました (STAT3、HNRNPA0の青色のバーの高さを、MYT-1 Exon 1のものと比較してください)。
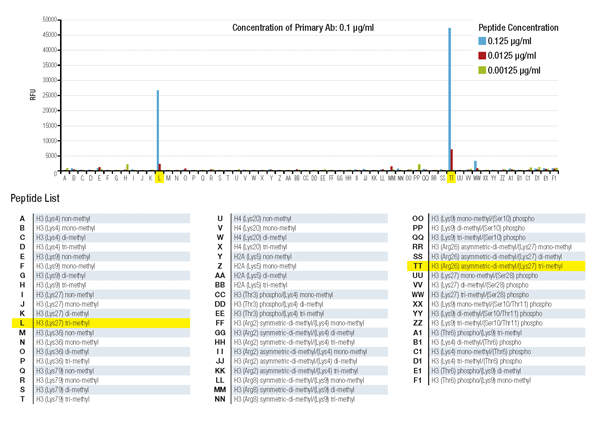
ヒストンペプチドアレイの結果から、Tri-Methyl-Histone H3 (Lys27) (C36B11) Rabbit mAb #9733はtri-methyl-histone H3 lysine27に特異的に結合すること、近隣のアルギニン26残基のメチル化の影響を受けないことが分かりました。

p300 (D2X6N) Rabbit mAb #54062およびNormal Rabbit IgG #2729によるK-562細胞のクロマチン免疫沈降 (ChIP) を行いました。クロマチンサンプルの調製、ChIPプロセスにはSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を用いました。ヒトSTAT3プロモーター、SimpleChIP® Human HNRNPA0 Promoter Primers #83602、SimpleChIP® Human MYT-1 Exon 1 Primers #4493のプライマーセットでリアルタイムPCRを行い、ChIPで濃縮されたDNAを定量解析しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。p300 (D2X6N) Rabbit mAbは、Normal Rabbit IgGのバックグラウンドと比較し、STAT3、HNRNPA0 (既知結合領域) の遺伝子領域を50倍以上濃縮しました (各標的遺伝子領域の青色と赤色のバーの高さを比較してください)。
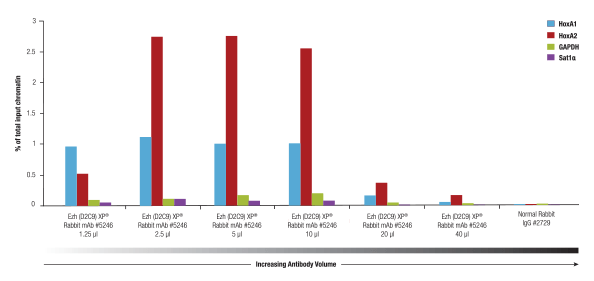
SimpleChIP® Plus Enzymatic Chromatin IP Kit #9005を用いて、4x10 NCCIT細胞のクロマチンサンプルをクロマチン免疫沈降し、Ezh2 (D2C9) XP® Rabbit mAb #5246の最適量を検討しました。この抗体は、各IPで2.5-5 µL使用した場合に最適な結果が得られました。
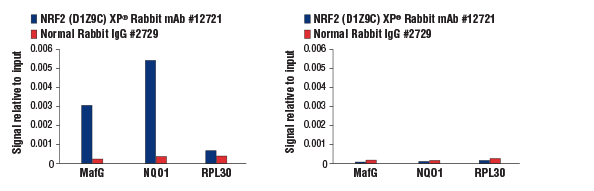
DEM (50 μM、3時間) 処理した野生型MEF (左図)、NRF2ノックアウトMEF (右図) から調製したクロマチンサンプルを用い、NRF2 (D1Z9C) XP® Rabbit mAb #12721またはNormal Rabbit IgG #2729でクロマチン免疫沈降 (ChIP) を行いました。ChIPで濃縮したDNAを鋳型に、mouse MafG intron 1 primers、SimpleChIP® Mouse NQO1 Promoter Primers #12635、SimpleChIP® Mouse RPL30 Intron 2 Primers #7015のプライマーセットでリアルタイムPCRを行い、定量解析しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。NRF2 (D1Z9C) XP® Rabbit mAbによる、 ノックアウト細胞内のMafGおよびNQ01の遺伝子領域 (NRF2の既知結合領域) の濃縮はみられず、抗体の特異性が確認できました (右図)。
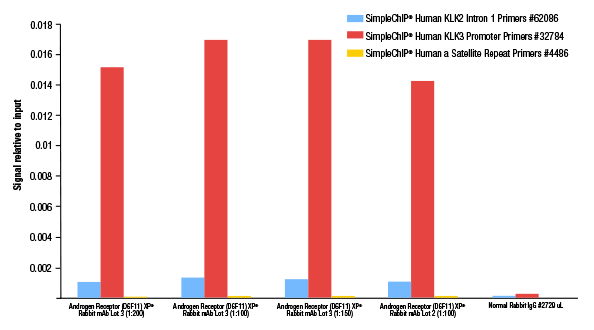
LNCaP細胞を5% FBS (活性炭処理済み) を含むフェノールレッド不含培地で3日間培養した後、Dihydrotestosterone (DHT、10 nM) で4時間処理し、SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を用いてクロマチンサンプルを調製しました。この実験では上記のクロマチンサンプルを用い、Androgen Receptor (D6F11) XP® Rabbit mAb #5153のロット3 (新ロット) の最適量を検討しています。比較対象として、ロット2 (旧ロット) を最適希釈率である1:100で用い、同様にクロマチン免疫沈降しました。SimpleChIP® Human KLK2 Intron 1 Primers #62086、SimpleChIP® Human KLK3 Promoter Primers #32784、SimpleChIP® Human α Satellite Repeat Primers #4486のプライマーセットでリアルタイムPCRを行い、濃縮されたDNAを定量解析しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。この抗体のロット2とロット3はどちらも1:100の希釈率で最適な結果が得られることが分かります。