View in English?
View in English?
多くの神経変性疾患の特性の1つとして、折り畳まれていない、あるいは誤った折り畳みを受けたタンパク質の蓄積が挙げられ、これは細胞毒性の原因となる神経原線維変化やプラーク形成を引き起こします。これらのタンパク質凝集体は、アルツハイマー病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症に関連しているため、これらの凝集体を形成することが知られているタンパク質の産生やプロセシングに必要なメカニズムを明らかにする研究への関心が高まっています。タンパク質の凝集体形成を標的とした新しい治療法を開発する上での課題として、作用メカニズムに関する知識が不十分であることや、症状の早期診断や治療への応答をモニタリングするためのバイオマーカーが不足していることなどが挙げられます。
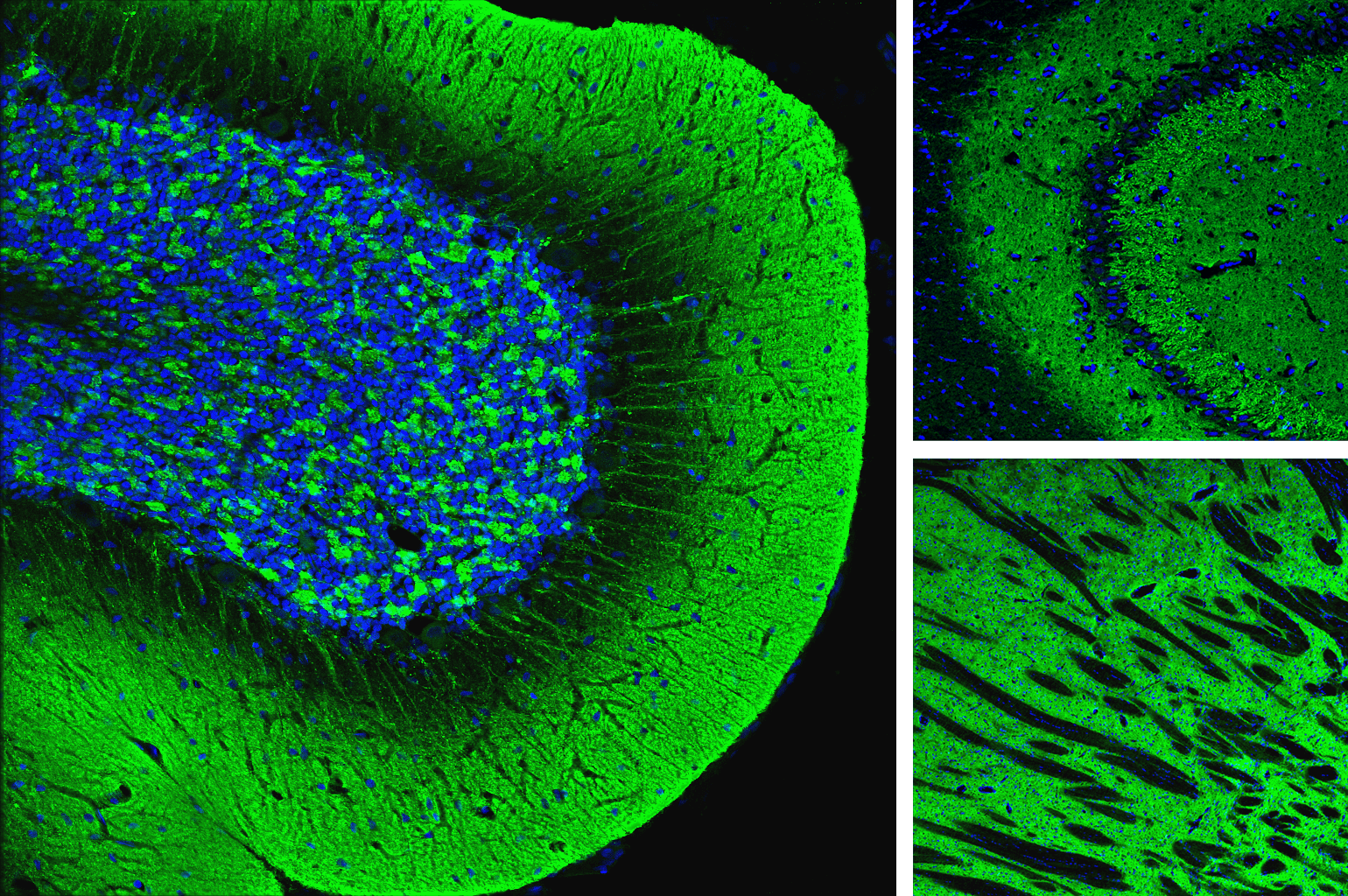
β-Amyloid (Aβ) はアルツハイマー病患者の脳にみられるアミロイド斑の主要な構成成分となるペプチドです。このペプチドはアミロイド前駆体タンパク質 (APP) がβ-Secretaseやγ-Secretaseによって切断されることで形成されます。
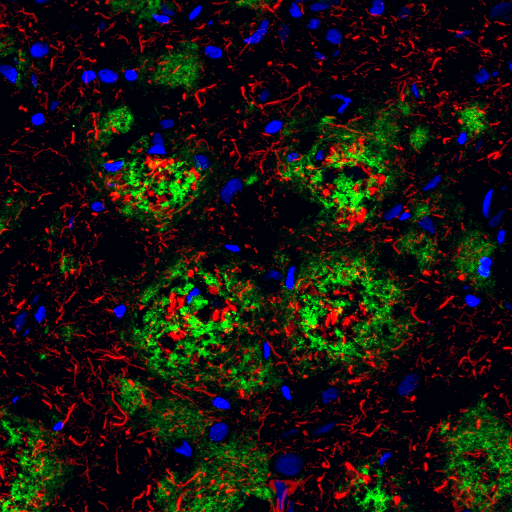
正常な細胞条件下で、Tauは特に軸索において微小管形成を促進し安定化します。TauのThr205のリン酸化は神経原線維変化でよく研究されており、アルツハイマー病の初期ステージでは低レベル、後期ステージでは高レベルになることが分かっています。
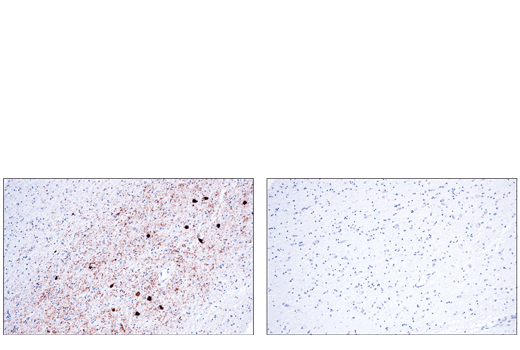
α/β-Synucleinは、常染色体優性遺伝性パーキンソン病のいくつかの家系で変異が観察されたことで注目を集めました。α/β-Synucleinは生体膜の安定性や代謝回転を調節するといわれていますが、正常な細胞機能ははっきりしていません。α/β-Synucleinの変異は家族性パーキンソン病の早期発症に関与しています。