View in English?
View in English?
リン酸化タンパク質に対する抗体は、しばしば関連タンパク質と交差反応し、偽陽性バンド・シグナルをもたらします。2つのXP®モノクローナル抗体、Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb #4370とPhospho-Met (Tyr1234/1235) (D26) XP® Rabbit mAb #3077について、いくつかのアプリケーションで他社製品と比較しました。
| CST #4370 | 他社製品 1 | 他社製品 2 | |
|---|---|---|---|
| ウェスタンブロットの希釈率 | 1:2000 | 1:100 | 1:100 |
| アッセイ濃度 (µg/mL) | 0.222 | 1 | 10 |
| 推奨アプリケーション | W, IP, IHC-P, IF-IC, F | W, IP, IF | W, IHC-P, IHC-F |
| 動物種交差性 | H, M, R, Hm, Mk, Mi, Dm, Z, B, Dg, Pg, Sc, (Ce) | H, M, R, Dg | H, M, R, (C, X, Z) |
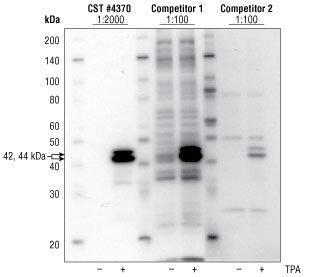
図 1 血清飢餓処理を一晩行ったJurkat細胞を、そのまま、もしくは既知のp44/42 MAPKアクチベーターであるホルボールエステルで処理し (200 nM TPA #4174、10分間)、ウェスタンブロットで解析しました。#4370はCST推奨希釈率で、他社抗体はいずれもメーカー推奨濃度範囲の最も高い濃度で使用しました。いずれの抗体でもTPA処理で期待通りのシグナルの誘導がみられましたが、他社製品では同時に強いバックグラウンドもみられました。特に他社製品1は多くの交差反応バンドがみられ、一方、他社製品2では全体的に弱いシグナルがみられました。
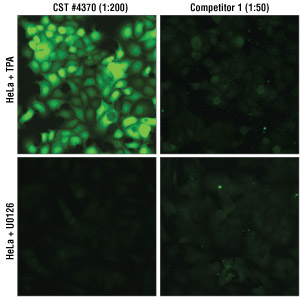
図 2 血清飢餓処理したHeLa細胞を、MEK 1/2阻害剤であるU0126 #9903 (10 µM、2時間)、またはTPA #4174 (200 nM、30分間) で処理しました。#4370はCSTが推奨する200倍希釈で使用し、他社製品1は、メーカー推奨に従い、希釈率範囲50-500倍希釈の間で最適条件を検討しました。他社製品では最適条件においてもU0126処理した細胞で核および細胞質にバックグラウンドがみられ、TPA刺激した細胞でも弱い拡散した細胞質シグナルがみられたのみでした。#4370による染色ではTPA処理後に期待通りのシグナルの増強がみられましたが、他社製品による染色ではほとんどみられませんでした。これらのことからCST製品でよりクリアな結果が得られることが分かります。
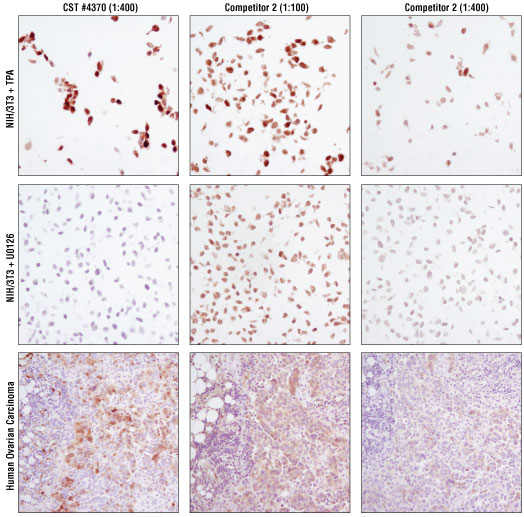
図 3 #4370によるIHC染色を、他社のIHC推奨製品 (2種の濃度) と比較しました。TPA #4174 (上) またはU0126 #9903 (中) で処理したパラフィン包埋NIH/3T3細胞ペレット#8103、およびパラフィン包埋ヒト卵巣がん組織 (下) を、上記抗体でIHC染色しました。細胞ペレットシステムにおいて、#4370ではCSTの推奨する400倍希釈で良好な染色像が得られました。他社製品2では、U0126処理した細胞 (ネガティブコントロール) でみられるバックラウンドを抑えるために400倍の希釈が必要ですが、この希釈倍率ではTPA処理した細胞 (ポジティブコントロール) でみられるシグナルも大きく減少しました。ヒト卵巣がん組織の染色において、他社製品2では100倍希釈 (推奨範囲内での最低倍率) で用いた場合でもシグナルが弱く、U0126処理した細胞ペレットでみられたようなバックグラウンドとの判別が困難でした。また、他社製品2を400倍希釈で用いた場合では染色がほとんどみられませんでした。一方、ヒト卵巣がんで、#4370で強く特異的な染色像が得られました。
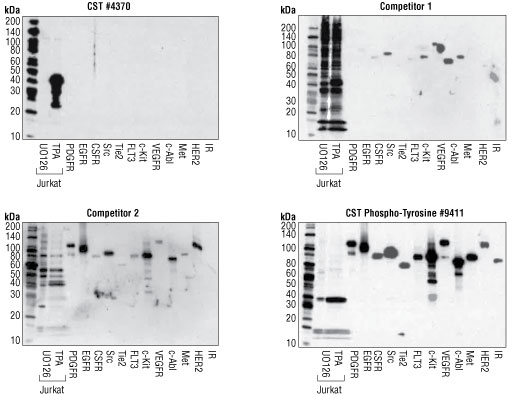
図 4 チロシンがリン酸化された一群のリコンビナントタンパク質をウェスタンブロットで解析した場合、他社製品1、2ではともにチロシンがリン酸化されたタンパク質への交差反応がみられましたが、#4370では交差反応が検出されませんでした。タンパク質のローディングと、タグの付いたリコンビナントタンパク質の分子量を確認するため、Phospho-Tyrosine Mouse mAb (P-Tyr-100) #9411によるウェスタンブロットの結果も示しました。これらの結果から、#4370が非常に優れた特異性をもつことが分かります。
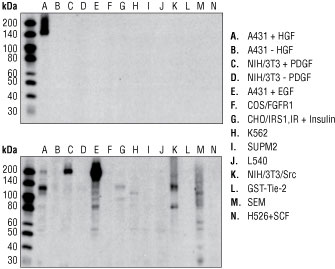
図 5 #3077を用いたウェスタンブロットで、HGF刺激したA431細胞では145 kDaのシングルバンドがみられましたが、無刺激のA431細胞ではみられませんでした (上)。また、増殖因子処理によるその他のRTKの活性化や、その他のRTK・細胞質のチロシンキナーゼの過剰発現を行った場合でも、非特異なバンドはみられませんでした。これに対して、他社のリン酸化Met抗体を用いた場合では、いくつかの非特異的なバンドがみられました (下)。図中のイメージは、2つのメンブレンを同じフィルム上で同じ時間 (10秒) の露光を行ったものです。
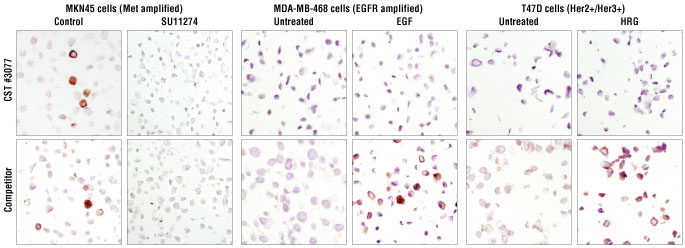
図 6 Met阻害剤SU11274で処理したパラフィン包埋MKN45細胞の免疫組織化学染色では、#3077、他社製品ともに、コントロールでみられた染色がみられなくなりました。EGF処理したMDA-MB-468細胞、HRG処理したT47D細胞 (ともに乳がん細胞株) を、#3077で染色した場合は、コントロールに比べて染色の増強はみられませんでした。一方、これらを他社製品で染色した場合は、非特異的な染色の増強がみられ、その他のRTKと交差反応することが示唆されました。