View in English?
View in English?
免疫蛍光染色 (IF) は、固定化した細胞や組織内の標的タンパク質の局在性、相対的な発現、活性化状態を研究するために抗体と蛍光検出を使用します。IFは様々な研究分野で広く使用されています。
IFで次のようなことを調べることができます:
免疫蛍光染色の関連技術は年々進化しています。このため、抗体による標的分子の特異的な認識と蛍光レポーターの検出技術は進化を続け、より高度な細胞特性解析ができるようになっています。生体サンプルの保存状態が良いことや、標的抗原に抗体がアクセス可能であることが重要ですが、そのほかにもサンプル、標的、抗体ごとに異なる課題が生じることがあります。
このページでは、プロトコールを進める上で役立つ情報をまとめ、よくある質問に答え、IF実験の設計のお手伝いをします。
最適なIF技術やプロトコールは生体サンプルの種類、サンプルを処理するステップ、標的抗原の特性、使用する抗体によって異なります。
以下の点にご注意ください:
シグナル強度が強く、バックグラウンドが最小限に抑えられた特異性の高い抗体を用いることが理想的です。ご使用予定のアプリケーションで検証済みの抗体を選択することが重要です。IFにおける抗体検証には、ポジティブ、ネガティブ発現実験 (ノックアウト細胞株、遺伝学的モデル、CRISPR、RNAi) や、標的タンパク質の局在性や翻訳後修飾 (PTM) の実験的操作、プロトコール最適化などがあります。
抗体の性能はアプリケーションによって異なります。例えばウェスタンブロットで高性能な抗体で、IFでも良好な結果が得られるとは限りません。新しい抗体の試験を行うと、わずかに非特異的な結合を持つものが見つかります。このような抗体は、IFやその他WB以外のアプリケーションには推奨しません。さらに、凍結組織の染色で高性能な抗体で、FFPEの染色では良好な結果が得られない場合、またその逆の場合もあり得ます。抗体の感度と性能は、サンプルの固定法や処理、抗体の使用条件によって変化します。
解析する生体サンプルとその調製方法が決まった後、cellsignal.comで抗体を検索する一番簡単な方法は、始めに適切なアプリケーションを選択することです。その後、検索語を入力するか他の特性 (宿主、研究分野、その他) を選択してさらに絞り込み検索し、必要なアプリケーションで検証されている抗体を選択します。
実験のデザインと結果、また抗体が正しく標的の情報を示すかどうかについて信頼性を確認するため、ポジティブコントロールとネガティブコントロールの実験は有効です。例えば:
Cell Signaling Technology (CST) の科学者は、抗体の検証プロセスの一環としてこのようなコントロール実験を日常的に行っています (実例はこちら)。ご自身の実験モデルでも同様のコントロール実験を設定することをお勧めします。これは良好な結果を得るのに困難を感じている場合に特に有効です。
標的を特異的に認識するのは一次抗体です。免疫動物種をもとに、二次抗体が一次抗体を認識して結合します。ラビットやマウスで産生された一次抗体はそれぞれ、抗ラビット (イムノグロブリン) 抗体、抗マウス (イムノグロブリン) 抗体で検出されます。
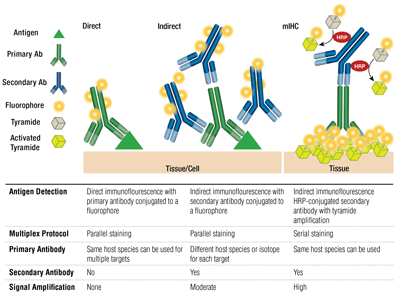
一次抗体と蛍光色素で標識した (一次抗体の免疫動物種に特異的な) 二次抗体を組み合せて使用することを間接染色と呼びます。一次抗体を蛍光色素で標識して用い、二次抗体を使用せずに染色することを直接染色と呼びます。直接染色法では実験にかかる時間が短縮され、また同じ動物種で産生された抗体を多重染色に用いることができるようになります。間接染色は、一次抗体1分子に対して複数の二次抗体が結合するために、シグナルが増幅されるのが利点です。
これらの手法には別のバリエーションもあり、ビオチン標識した一次抗体を蛍光標識したアビジン/ストレプトアビジンと組み合せる手法などがあります。二次抗体として蛍光標識したF(ab’)2断片 (Fc領域を欠く) を利用することで、バックグラウンドが低下します。mIHCでは、HRP (西洋ワサビペルオキシダーゼ) 標識した二次抗体で、蛍光標識したチラミドの沈着を触媒します。
抗体蛍光色素の選択
それぞれの標的を波長の異なる (色の異なる) 蛍光色素で標識した複数の抗体で染色し、同時染色 (マルチプレックス解析) することができます。間接法の場合、多重染色のキャパシティは、それぞれの一次抗体を染め分けられる蛍光標識した二次抗体に依存します。アイソタイプの異なるマウス抗体はアイソタイプ特異的な二次抗体で染め分けることができ、同時に最大5種のマウス抗体を別個に染色することができます。直接法の場合、それぞれの一次抗体を異なる蛍光色素で標識します。このため、免疫動物種やアイソタイプの一致する抗体を多重染色に利用することができます。また、マウス抗体を用いてマウス組織を染色する場合にも、抗マウス二次抗体で生じるバックグラウンドが問題にならないため、有効な手段です。
マルチプレックスIF実験をデザインする場合は、スペクトルの重複を避けるため、励起光源やフィルターセットなど、蛍光顕微鏡の特性を考慮する必要があります。現代の落射蛍光顕微鏡や共焦点蛍光顕微鏡は通常、3つ以上のチャンネルを区別する機能を備えています。
未固定の生細胞や固定後の細胞を染色する細胞染色色素を、IFのワークフローに組み込むことができます。標的の細胞内局在性を確認する場合はオルガネラの標識もよく利用されます。GFPなどの発現タグも、トランスフェクションした細胞の追跡やモザイク実験などでよく利用され、GFPの蛍光シグナルが弱い場合はIFで抗GFP抗体を用いることがあります。細胞染色色素や蛍光タンパク質を使用した場合はそれによってチャンネルが占有されるので、使用できる抗体の数が減ることに注意が必要です。
実験に用いる蛍光色素の選択は、利用できる励起光源や励起/蛍光フィルターのスペクトル特性に依存します。蛍光の漏れ込みを避けるため、実験を始める前に蛍光色素の励起/蛍光プロファイルを確認してください。CSTは、Alexa Fluor®などの様々な蛍光色素で標識した一次抗体や二次抗体を提供しています。
組織切片は、OCT (optimal cutting temperature) コンパウンド中で急速凍結するか、固定してパラフィン包埋することで調製できます。凍結サンプルは、次のステップの前にクライオスタットを用いて薄切し、スライドにはり付けて10-15分間風乾させた後に固定します。FFPE (formalin-fixed paraffin-embedded) 組織サンプルの場合は、個々の組織のタイプによって採取、固定、パラフィン包埋のステップが異なります。
一般的に、FFPE組織はOCTコンパウンドで包埋された凍結組織より形態がよく保存されます。このため、陽性細胞の数値化や染色どうしの境界の特定が容易になる場合があります。FFPE組織は非常に安定で、組織ブロックを数年保存することができます。また、研究室間の輸送も容易で、ヒトの病理標本に適した処理方法です。
一方、FFPEサンプルの場合、タンパク質分解によって抗原の総量が減少するステップがあり、残った抗原を検出するために賦活化処理が必要で、アルデヒドによって自家蛍光が強化されます。量の多いタンパク質を除き、残った抗原を間接IFで検出するのは困難で、適切な染色像を得るためにシグナルの増幅が必要な場合があります。また、抗原の賦活化処理で、通常は検出されない抗原が染色されるようになり、予期しない非特異染色がみられることもあります。エピトープを検出するために特別な賦活化処理が必要な標的もあります。このため、抗体の検証法と使用法を慎重に検討することが重要です。
OCTコンパウンドで包埋した凍結組織の場合は、形態より処理を削減することが優先されます。包埋の前処理が少なく、切片化すると同時に染色の準備が整うので、これが最速で免疫染色の結果を得ることができます。タンパク質分解も少なく、過酷な賦活化処理も不要で、多くの抗原が抗体に結合することができます。シグナルの増幅を必要としないので、組織サンプルの質の影響を大きく受けます。固定の方法 (アルコールやアルデヒド) や処理時間 (転写因子などのいくつかの標的は固定に必要な時間が短い)、組織サンプルの新鮮さ (特に切片化の後) は全て重要で、標的ごとに異なります。最後に、凍結組織は切片化した後に固定などの処理を行うため、アッセイのデザイン大幅にカスタマイズすることができ、標的の選択を柔軟に行うことができます。
蛍光顕微鏡に適合した支持体に細胞を播種する必要があります。通常はガラス底面の細胞培養ディッシュやカバーガラス (プラスチック製の細胞培養ディッシュ上にカバーガラスを置いて) を用い、細胞接着をサポートするためにポリリジンや細胞外マトリクス成分でコーティングします。顕微鏡に対応した市販のマルチチャンバースライドガラスを用いることもできます。
培養条件が細胞の健康状態、形態、標的タンパク質の発現や局在性に影響を及ぼし、最終的にIFデータの品質に関わることに注意してください。こまめに培地のpH変化や、ストレスの兆候 (多核化した細胞など) を低倍率の顕微鏡観察でチェックして、細胞の健康状態を確認してください。細胞の種類や標的に応じて、細胞密度が適切に保たれていることも重要です。
理想的な固定液によって「生きているような」細胞のスナップショットを保持します。クロスリンクによって細胞内在性の酵素を阻害し、自己分解などの分解プロセスを速やかに停止して抗体が認識する抗原を提示させます。残念ながら、サンプルや抗原を問わず常に理想的な固定ができる方法はありません。同一の標的タンパク質でさえ異なる抗原は異なる挙動を示します。このため、最適プロトコールはサンプルの種類だけでなく、エピトープ (あるいは抗体) によっても異なります。
新鮮な凍結組織場合、クライオスタットで薄切した後に切片を固定液で処理する必要があります。一方、組織サンプルを初めに経心腔的灌流や浸漬処理で固定して保存することもあり、固定済みのサンプルを凍結してクラオスタットで切片化することもあります。
FFPE組織処理の場合は、組織をホルマリン (またはアルデヒドベースの固定液) による浸漬固定や上記の灌流を行って保存し、その後にパラフィン包埋や切片化を行います。抗体とインキュベーションを行う前に、切片を脱パラフィン処理、再水和、抗原の賦活化処理を行う必要があります。これによって標的分子に抗体がアクセスして結合できるようになります。
固定操作の直前に、温めた無血清 (タンパク質成分を含まない) 培地やPBSで細胞を洗い、細胞外の沈殿物や細胞残屑を除去します。速やかに固定液に交換することで迅速に固定を行います。
構造の保持を優先させる場合は、ホルムアルデヒド、ホルマリン (溶解したホルムアルデヒドと低濃度のメタノールの混合物)、グルタルアルデヒドなど、アルデヒドベースの固定液がよく使用されます。CSTはほとんどの抗体で4%ホルムアルデヒド (メタノール不含) による固定を推奨しています。アルデヒドは細胞タンパク質の一級アミンと反応してクロスリンクし、サンプルを安定化します。また、ホスファターゼやプロテアーゼなどの細胞内酵素がクロスリンクによって不活性化します。アルデヒドは細胞膜を透過して可溶性タンパク質をアルコールよりよく固定しますが、アルデヒドによるクロスリンクで抗原性を失う標的もあります。
メタノールなどの脱水/変性アルコール固定液は、細胞内高分子周辺の水分子と置き換わり、生体内原位置 (in situ) でこれらを変性させ、沈着させます。標的タンパク質が変性することで埋没していたエピトープが露出することがあり、一部の抗体についてはアルデヒドによる固定よりこのアプローチの方が有利な場合があります。しかし、脱水固定液は可溶性の抗原や修飾状態に特異的な抗体 (リン酸化特異的抗体など) にはあまり適しません。製品データシートで最適の固定法を確認してください。
クロスリンク固定液で固定を行った場合、細胞膜は無傷のまま残り、抗体は細胞内抗原にアクセスすることができません。したがって、細胞外エピトープを認識する抗体を除いて、クロスリンク固定の後に透過化処理をする必要があります。最適な透過化法は抗体によって異なるので、製品ページで推奨プロトコールを確認してください。
固定後にTriton® X-100を用いて透過化するのが一般的です。Tritom、NP-40、TWEEN®、Saponin、Digitonin、DOTMACなどの界面活性剤は細胞膜に結合して様々なサイズの「孔 (pore)」を形成し、抗体のアクセスを可能にします。
一方、固定ステップの後、エタノールやメタノールなどのアルコールで透過化処理をすることもあります。これは、クロスリンク固定液による迅速な固定と、タンパク質の中程度の変性と膜の脱脂を組み合せた方法です。これによって一部の標的のシグナルが改善することがあり、特にオルガネラや細胞骨格に結合する標的に有効です。
CSTで推奨するプロトコールが異なる抗体を用いて多重染色する場合、どの抗体を最適条件で使用するか、優先順位を付ける必要がある場合があります。mIHCにおける順序の最適化の例は、こちらのアプリケーションノート (PDF) に記載されています。スモールスケールの実験で様々なプロトコールを比較した後、実験規模を拡大することをお勧めします。
最も一般的に推奨されているものは、PBSに5%正常ヤギ血清 (あるいは二次抗体の免疫動物種の血清) と0.3% Triton® X-100を加えたものです。製品データシートで推奨ブロッキング試薬を確認してください。
サンプルにFc受容体が存在する場合、特異的な標的の認識 (抗原を認識する抗体の可変領域を介した結合) に由来するシグナルのほか、非特異吸着 (抗体の重鎖とFc受容体の結合) に由来するシグナルも検出されます。動物の血清に存在する総IgGはFc受容体を遮断し、一次抗体と二次抗体の結合を防ぎ、バックグラウンドノイズを低減します。蛍光標識したF(ab’)2断片を利用することでも、二次抗体のFc受容体への非特異的結合が抑えられます (この場合、一次抗体の非特異的結合は避けられません)。
ウェスタンブロットなどのその他の抗体ベースの実験では、ブロッキングのステップによって一次抗体や二次抗体が本来の標的以外の部位に低い親和性で非特異的に結合することを抑えます。しかし、IFでは厳密に試験されたラビットモノクローナル抗体は、ブロッキングの有無に関わらず良好に機能することが経験的に分かっています。結局のところ、バックグラウンドノイズを避けるためには、蛍光免疫染色で検証された高品質な抗体を選択することが効果的です。
シグナルとノイズの比率 (S/N比) は特定のアプリケーションにおける抗体の特異性と感度を示しています。S/N比は、目的の標的分子を発現する細胞の蛍光強度の「シグナル」を、発現の無い細胞の「バックグラウンドノイズ」と比較することで計算できます。抗体の濃度が低すぎると、蛍光シグナルが暗すぎてバックグラウンドノイズと区別できなくなります。反対に、濃度が高すぎるとバックグラウンドレベルが上昇してS/N比は低下します。常に製品のデータシートに記載されている推奨抗体希釈液を確認してください。これは抗体検証ステップで行うタイトレーションに基づくものです。
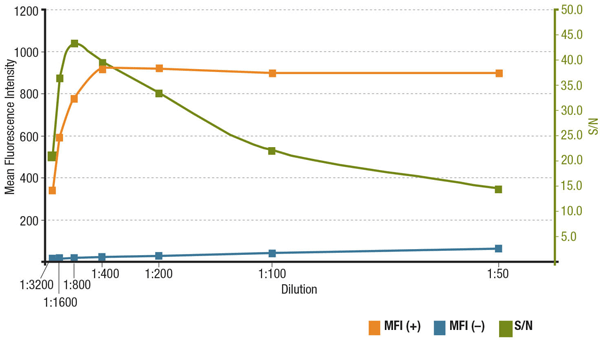
段階希釈したMUC1 (D9O8K) XP® Rabbit mAb #14161のS/N比の解析。 MFIを発現するZR-75-1細胞 (MFI(+)、橙) と、発現しないHCT 116細胞 (MFI(-)、青) の平均蛍光強度と計算されたS/N比を示しました (緑) 。
一般的に、4°Cで一晩インキュベーションすることで強いシグナルが得られます。インキュベーション時間と温度を変えるとシグナルとS/N比が変化します。抗体によってインキュベーションの条件の変化の影響が異なる場合ことがあります。詳細はこのブログ記事をご覧ください。
IFは適切な励起光源とフィルターを備えていれば、落射型蛍光顕微鏡、走査型共焦点顕微鏡、スピニングディスク共焦点顕微鏡のいずれを用いても行うことができます。また、通常は全内部反射蛍光 (TIRF:total internal reflection fluorescence)、ライトシート顕微鏡、一部の超解像技術など、特殊な免疫蛍光検出技術で解析することも可能です。
IF-IC検証済み抗体はいずれも、ハイスループットスクリーニング (HCS)/ハイコンテント解析 (HCA)に使用できます。これらの実験は標準的なIF技術に基づいて、自動化されたものです。
IF実験でお困りごとがありましたら、こちらからトラブルシューティングガイドをご覧いただくことができます。
Cell Signaling Technology、CST、XPは、Cell Signaling Technology, Inc.の商標です。All other trademarks are the property of their respective owners.