View in English?
View in English?
研究対象の標的抗原や使用するアプリケーションによっては、抗体検証で相補的戦略を用いるのが望ましい場合もあります。このアプローチによって抗体の特異性や機能性に関する重要な情報を得ることができ、標的の生物学的な性質だけでなく下流のアッセイの厳密な必要条件に合わせて注意深く調整することができます。
相補的戦略には、翻訳後修飾 (PTM) に対する抗体の特異性を確認するためのペプチドアレイやELISA、特定の抗原への抗体の結合を防ぐ様々なペプチドブロッキング法などがあります。プロトコールの最適化や、抗体をアゴニストとして用いる中和やタンパク質の活性化などの機能アッセイも相補的戦略に含まれます。これら全ての方法によって、ほかの検証戦略の結果をさらに裏付けるデータが得られます。
リン酸化、アセチル化、メチル化、ユビキチン化、SUMO化などの翻訳後修飾はタンパク質に変化をもたらす主な原因です。タンパク質に存在する翻訳後修飾の数とタイプは構造と機能の両方に関わる可能性があるので、これらの修飾を検出および定量するための非常に特異的な抗体が必要とされます。
主にヒストン修飾に対する抗体検証に使用されますが、他の翻訳後修飾、ペプチドアレイ、競合ELISAに対する抗体も、翻訳後修飾の特異性を決定し、近位の修飾が抗体の特異性と感度に及ぼす影響を評価するのに役立つツールです。複数の翻訳後修飾を同時に評価する機能を持つことで、これらのシステムからは大量の価値あるマルチプレックスデータが迅速に得られます。
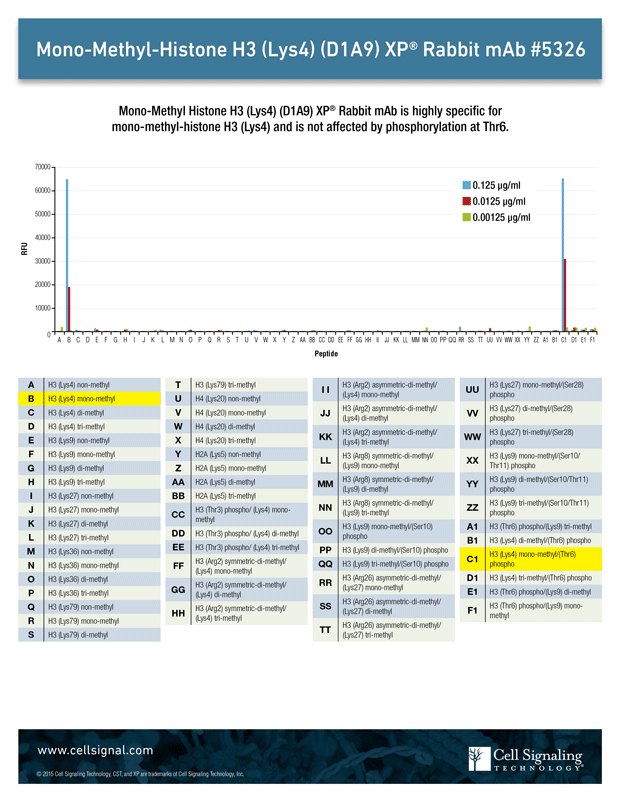
修飾および非修飾のヒストンテールのペプチドアレイを用いて抗体の特異性を検証することができます。図1は、このようなアレイによって、選択したペプチドおよび修飾に対してMono-Methyl-Histone H3 (Lys4) (D1A9) rabbit mAbをスクリーニングする方法を示しています。その結果、抗体がHistone H3のアセチル化リジン4を特異的に検出したことの他、例えば、セリン6でのリン酸化など近隣の修飾は抗体の特異性や機能に影響しないことが示されました。
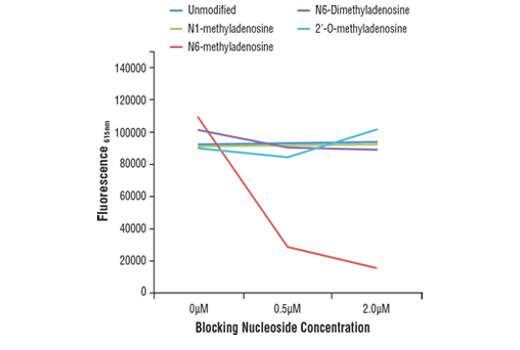
ELISAは、図2に示すように、抗体特異性の評価にも広く使用されています。ここでは、競合ELISAを用いてN6-Methyladenosine (m6A) (D9D9W) rabbit mAbを検証しました。これは、m6Aオリゴヌクレオチドでプレコートしたマイクロプレートウェルにて、修飾アデノシンの濃度を差次的に増加させ抗体をインキュベートすることで実施しました。その結果、抗体のm6Aへの結合は遊離のm6Aヌクレオシドによってのみ阻害されることが示され、これは標的に対する特異性を示します
小分子あるいは非タンパク質性の標的に対する抗体の検証においては、抗体がバイオシミラーを検出することなく、目的の部分に特異的かつ高感度に結合することを確認することが重要です。これは、オフターゲットな結合が実験結果を大幅に妨害しデータが使えなくなる可能性があるためです。これらの例では、例えばELISAを実施することによって、意図された抗原と、同様のサイズおよび形状を持つ他の化合物の両方に対する抗体の反応性を比較するのがよいでしょう。
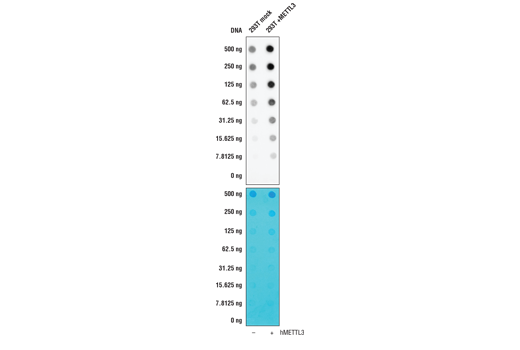
ELISAより簡単なアプローチは、メンブレンにブロットされたサンプルに対して検証されている抗体をスクリーニングするドットブロット技術を使用することです。この方法は、図3に示すように、翻訳後修飾の抗体特異性を評価する相補的戦略としてよく使用されます。ただし、ドットブロットは抗体特異性を試験する迅速かつ簡単な方法ではありますが、データを適切なものとするには、実験デザインを常に慎重に検討し適切に制御する必要のあることに注意してください。
図3は、多様なMyc/DDKでタグ付けされたMAGEアイソフォームを発現する構造物でのトランスフェクションの後、293T細胞から調製したライセートを用いた、MAGE-A3抗体のウェスタンブロッティング解析を示しています。MAGE-A3は、多様な腫瘍細胞に発現することの多い核タンパク質で、293Tにより内在的に発現されることはありません。このデータは、トランスフェクションの成功を確認するDYKDDDK抗体とローディングコントロールとして用いるβ-Actin抗体の結果と、MAGE-A3に対する抗体の特異性を示しています。
この検証実験では、先に述べたのと同じN6-Methyladenosine (m6A) (D9D9W) rabbit mAbを、N6-メチルアデノシンの産生を誘導するタンパク質であるMETTL3の発現の有無において293T細胞から得たRNAに対して試験しました。標的への抗体の結合はMETTL3の濃度によって明らかに影響を受けており、標的に対する特異性に確信が得られます。
ペプチド競合アッセイにおいて、検証される抗体は下流のアプリケーションで使用される前に免疫ペプチドとインキュベートされます。理論的には、ペプチドに結合する抗体は抗原性の標的の検出を妨げます。ただし、ペプチド抗原は、抗体が結合するすべてのタンパク質への抗体の結合を阻害するため、ペプチド競合を単独で検証とすべきではありません。他の検証戦略を、ペプチド競合アッセイと組み合わせて使用することが不可欠です。
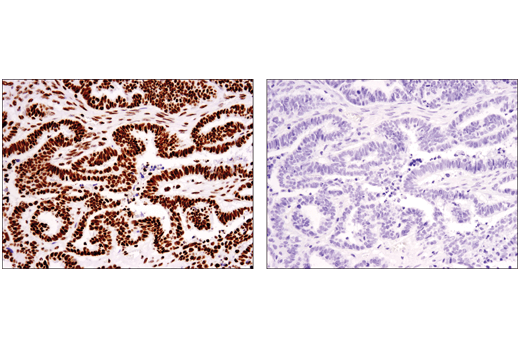
それでも、修飾ペプチドと非修飾ペプチドを直接比較できるため、ペプチド競合は翻訳後修飾に対する抗体検証に有用です。図4は、このアプローチを使用した免疫組織化学染色によるTri-Methyl-Histone H3 (Ly36) (D5A7) rabbit mAbの評価を示しています。抗体を非修飾ペプチド (左) あるいはトリメチルブロッキングペプチド (右) とインキュベートした後、卵巣がん切片を免疫組織化学染色で解析しました。その結果、抗体の染色はメチル化修飾に特異的であることを裏付ける証拠が得られました。
全体を通して、ある検証戦略が他の検証戦略よりも優れていることはなく、ここで説明するどのアプローチも単独で使用するべきではないことを強調してきました。抗体ベースのアプリケーションには、それぞれ独自の条件セットがあり、抗体の特異性や感度、機能性に関する様々な課題が提示されます。一例として、ウェスタンブロットで極めて高い特異性を示す抗体でも、免疫組織化学染色では非特異的であったり、機能アッセイでは使用できない場合があります。したがって、目的のモデル系でアプリケーションに合致する戦略やプロトコールを用いて、1つ1つの抗体を検証することが非常に重要になります。
CSTでは、ここに記載された戦略を採用して抗体試薬の信頼性を保証し、抗体が適切に機能することを研究者が期待できるアプリケーションを示しています。最終的に、目的のアプリケーション、プロトコール、モデル系で抗体が確実に機能するかどうかは、製品のエンドユーザー次第です。時間をかけて各々の実験システムを個別に最適化することは、研究を加速する正確な結果を生み出すのに重要です。