View in English?
View in English?
クロマチン免疫沈降 (ChIP) アッセイは、細胞に自然な状態で存在するクロマチンのタンパク質とDNAとの相互作用を解析するための、強力かつ多機能な手法です。このアッセイは、ゲノムの特定領域に結合する複数のタンパク質の同定、またはその逆の特定タンパク質が結合する数多くのゲノム領域の同定に使用することができます。さらに、ChIPアッセイは、特定のタンパク質-DNA相互作用の時空間的な相関の解析に使用することができます。例えば、ChIPアッセイは、様々なタンパク質因子がある遺伝子プロモーターへリクルートされる特徴的な順番の決定、または遺伝子活性化の間に遺伝子座全体にまたがる特定のヒストン修飾の相対量の「測定」に使用することができます。ヒストンタンパク質に加え、ChIPアッセイは、転写因子の結合、転写コファクター、DNA複製因子、DNA修復タンパク質などの解析にも使用することができます。
はい。SimpleChIP® Plus Sonication Chromatin IP Kit #56383、SimpleChIP® Plus Enzymatic Chromatin IP Kit #9004 および#9005は、培養細胞と組織サンプルの両方で使用できるように開発され、クロスリンク処理、クロマチン調製、免疫沈降を実施するために必要な詳細なプロトコールが用意されています。さらに、SimpleChIP® Plusプロトコールは容易にサイズアップが可能で、ユーザーは必要な免疫沈降の回数に基づいて、プロトコールの各段階で使用する試薬の量を簡単に決定することができます。
SimpleChIP® Plus Sonication Chromatin IP Kit #56383、SimpleChIP®Enzymatic Chromatin IP Kit (Magnetic Beads) #9003、SimpleChIP®Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005は、すべてChIP-Seq 実験で使用することができます。これらのキットには、DNAブロッキング試薬を必要としないプロテインG磁気ビーズが含まれます。このことはChIP-Seqにとって極めて重要です。なぜなら、そのようなブロッキングDNAのキャリーオーバーが、その後に得られるシーケンシングリードにコンタミネートしてしまうからです。
ソニケーション条件の最適化に加え、クロスリンク時間もまた、ソニケーションベースのクロマチン断片化に極めて大きな影響を与える可能性があります。組織サンプルでChIPを行う場合、クロスリンク時間を10分間から30分間へ延長すると、クロマチンに結合するような転写因子や転写コファクターのようなターゲットの濃縮を高めることができます。クロスリンク時間を延長するとクロマチン断片のサイズが大きくなる可能性がありますが、クロマチンのソニケーション中にクロスリンクされた転写因子と転写コファクターを保持しなければいけないことがしばしばあります。適切な断片サイズの範囲についての詳細は、プロトコールと下の「クロマチンサンプルは、アガロースゲルに泳動した際にどのようなパターンで観察されるのが適切でしょうか?」をご覧ください。
ソニケーションベースのクロマチン断片化条件を最適化するためには、せん断力、ソニケーション時間、ソニケーションバッファーのすべてが考慮されなければなりません。SimpleChIP® Plus Sonication Chromatin IP Kit #56383には、転写因子や転写コファクターの免疫沈降に適した穏やかなソニケーションが可能な、Cell and Nuclear Lysis Bufferが含まれています。なお、これらのバッファーは、ヒストンやヒストン修飾の免疫沈降でもよく機能します。
目的の抗体でChIP実験のクロマチン免疫沈降を行うためには、クロスリンクされたクロマチンが、およそ150 - 900塩基対 (bp) の長さのフラグメントに断片化されている必要があり、最終的にはこれらは細胞核から放出される必要があります。ソニケーションまたは酵素消化のいずれの方法でも、適切な長さのクロマチンを調製することができます。
クロマチンの断片化に使用される従来の方法であるソニケーションは、効果的にクロマチンをせん断するために超音波エネルギーを利用します。ソニケーション処理されたクロマチンは、豊富に存在しクロマチンの安定的な成分であるヒストンとヒストン修飾を評価するためのChIPではよく機能します。しかし、過剰なソニケーションはクロマチンを損傷したり、結合した転写因子や転写コファクターを引き剥がしたりする可能性があるため、通常、ソニケーションには最適化が必要とされます。CSTは、転写因子や転写コファクターの分解やクロマチンからの解離を防ぐために、SimpleChIP® Plus Sonication Chromatin IP Kit #56383に含まれるCell and Nuclear Lysis Bufferを開発・最適化しました。その結果、ChIPシグナルが劇的に改善されました。性能比較データを見る
酵素消化では、Micrococcal Nucleaseを使用してヌクレオソーム間のリンカ―領域を切断します。これは穏やかにクロマチンを断片化し、クロマチンとその結合タンパク質の完全性を保ちます。したがって、存在量が少なくDNAとの相互作用がより不安定な、転写因子と転写コファクターを評価するChIP実験により適しています。さらに、ソニケーションと比較すると、酵素消化は実験間でよりよい再現性を提供します。ただし、過剰に消化した場合、ヌクレオソームフリーの領域を失う可能性があります。
クロマチン調製に使用する細胞数や組織の量を測定することは、酵素消化によるクロマチン断片化において非常に重要です。CSTでは、計画している各免疫沈降反応ごとに、4 x 106細胞、もしくは25 mgの組織を採取することを推奨しています。組織サンプルは、クロマチンの酵素消化の前にクロスリンクされ、単一細胞懸濁液に破砕されます。クロマチン消化に用いたMicrococcal Nuclease量に対する細胞数の比は、クロマチンを適切なサイズ (150 - 1000塩基対) へと断片化するために極めて重要です。この比は、細胞タイプまたは組織タイプによってもわずかに異なりますが、CSTでは、4 x 106細胞 (あるいは25 mgの組織) に対して0.5 µLのMicrococcal Nucleaseを使用する比率で、クロマチンを再現性高く適切なサイズに断片化できることを見出しました。各SimpleChIP®キットには、細胞や組織を用いたクロマチン消化の最適化に役立つトラブルシューティングガイドが提供されています。
バッファーAとバッファーBでのインキュベーションは、ホルムアルデヒドでクロスリンクした細胞膜や核膜を完全には溶解しません。その代わりに、細胞への透過性にのみ作用してMicrococcal Nucleaseが浸透しやすくなり、クロマチンの断片化が可能になります。クロマチンを溶液に放出させるため、軽いソニケーション処理が必要です。このソニケーション処理により、クロマチンがこれ以上断片化されることはありません。
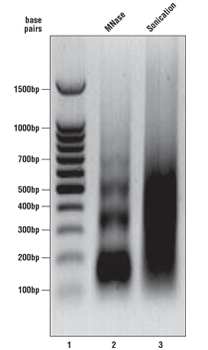
SimpleChIP®キットのプロトコールに沿って、酵素消化後に続く免疫沈降の前に、クロマチンサンプルを解析しました。最適なクロマチンの様子は、エチジウムブロマイドで染色された1%アガロースゲル (右図) をご覧ください。DNAマーカーはレーン1、MNaseで消化されたクロマチンDNAはレーン2、そしてソニケーションで断片化されたクロマチンDNAはレーン3です。MNase消化されたクロマチンDNAは、モノ-、ジ-、トリ-、テトラ-、ペンタ-ヌクレオソーム単位 (長さ150 - 1000塩基対、レーン2) へとせん断されるのが最適です。一方、ソニケーションで断片化されたクロマチンDNAは、100 - 1000塩基対 (レーン3) の範囲でスメア状に観察されるのが最適条件です。CSTでは、OD260に基づいてクロマチンDNAの濃度を決定しており、通常、様々な細胞や組織タイプで125 - 250 µg/mLになります。クロマチンサンプルが、この図にあるクロマチンの様子と大きく異なる場合は、各プロトコールに記載のクロマチン消化の最適化のためのAppendixをご参照ください。
注意: ソニケーションによってクロマチンを断片化する場合は、目標のサイズ範囲 (200 - 1000 bp) になる最低回数のソニケーションに留めてください。クロスリンク時間を長くすると、断片サイズが大きくなります (断片の30 - 60%が1 kb未満)。この場合でのさらなるソニケーション処理は、DNAから非ヒストンタンパク質が解離する原因となる可能性があり、転写因子または転写コファクターの抗体を用いたChIP実験では避けるべきです。
注意: 酵素によるクロマチン断片化で、150 bp (モノヌクレオソーム) 近辺でシングルバンドしか観察されない場合は、クロマチンが過剰消化されています。使用している細胞数または組織量に対して、ヌクレアーゼの添加量が多すぎます。ヌクレアーゼを少なくするか、消化する細胞数や組織量を増やしてください (最適化にはプロトコールのAppendixを参照)。
CSTでは、免疫沈降 (IP) ごとに通常、すべてのタンパク質標的に対して4 x 106個の細胞、もしくは25 mgの組織サンプルからスタートします。これは通常、IPごとに10 - 20 µgのクロマチンを必要とするためです。ただし、1 x 106細胞、または2.5 - 5 µgのクロマチンなどの少量でも、ヒストンのIPでは機能します。ソニケーション処理されたクロマチンは、必ず1X ChIPバッファーで1:4以上の希釈率で調製してください。これによって、通常は、500 µL以上の反応液量になります。反応液量が500 µLを超える場合は、抗体やProtein Gビーズの追加は必要ありませんが、インキュベート時間を延長すると効果的です。酵素法で調製されたクロマチンサンプルでは、希釈操作はオプションです。IPは目的量に関わらず未希釈のクロマチンを使用することも可能です。
CSTのChIP検証済み抗体の場合は、製品データシートでIPに使用する適切な抗体量をご参照ください。SimpleChIP®キットで使用する希釈率は、「推奨される抗体希釈率」の項目に記載がありますが、抗体の正確な量と検証実験に使用するクロマチン量は、抗体製品データーシート上の「クロマチンIP」図の説明内にあります。CSTで抗体を検証する場合、IPごとに4 x 106細胞 (クロマチン10 - 20 µg) を用いて常に抗体をタイトレーションし、酵素およびソニケーションの両方のプロトコールで最適希釈率を決定しています。
その抗体がCSTでChIP用に検証されていない場合は、ChIPアッセイにおける抗体のパフォーマンスを保証することはできません。目的の標的に対するChIP検証済み抗体がなく、他のCST抗体をChIPアッセイに使用してみる場合は、IP検証済み抗体を選択することを推奨しており、その場合はクロマチンIP反応ごとに0.5 - 5 µgの抗体の使用をお勧めします。ChIP未検証のCST抗体を用いて実験が成功した場合は、ぜひフィードバックをお聞かせください (こちら、あるいは[email protected]へメールでご連絡ください)。
2種類のビーズは、SimpleChIP®キットで同様に機能します。両方のビーズを並べて比較したところ、同じように最小限のバックグラウンドシグナルと特異的結合を示しました。アガロースビーズは、IPに使用される従来のビーズです。一方、磁気ビーズはやや高価ですが、より使いやすい特徴があります。洗浄バッファーを吸引除去する際、磁気ビーズはチューブの側面に付着するため、洗浄バッファー吸引中にロスが生じず、またビーズの完全な洗いが可能です。磁気ビーズは遠心分離を必要としませんが、Magnetic Separation Rack (#7017または#14654) が必要です。
磁気ビーズは、DNAブロッキング剤で処理していないため、ChIPシーケンシング実験に使用することができます。アガロースビーズは、ソニケーション処理済みのサケ精子DNAでブロッキングすることで、バックグラウンドシグナルを減少させています。ブロッキングDNAのキャリーオーバーは、ハイスループットシーケンシングを行う場合のシーケンスリードに影響します。
CSTでは、定量的リアルタイムPCRを利用して抗体を検証しており、サンプルには、総inputクロマチンの2%から4点の5倍段階希釈サンプルを用いています。CSTではこの希釈シリーズを使用して、各inputクロマチンqPCRサンプル (2%、0.4%、0.08%、0.016%) のCT値の検量線を作成します。これによって、それぞれのqPCR反応のCT値を総inputクロマチンのパーセンテージへと換算することで、各IPサンプルのDNA濃縮を算出することができます。
キットに含まれるコントロール抗体のHistone H3 (D2B12) XP® Rabbit mAb (ChIPFormulated) #4620と、コントロールプライマーのSimpleChIP® RPL30 primersを使用する場合、RPL30プロモーターの濃縮が総inputクロマチンの2 - 4%になるのが最適条件です。Normal Rabbit IgG #2729でわかるバックグラウンドの濃縮は、総inputクロマチンの0.1%未満になるようにする必要があります。
「ポジティブ」なChIPは、特異的なゲノム座位 (例:転写因子のその標的プロモーターへの結合) の抗体濃縮結果として定義しています。例えば、同じ抗体を用いた非特異的座位の濃縮よりも少なくとも4倍大きく、Normal Rabbit IgG #2729を用いた場合よりも少なくとも5から10倍大きい数値となります。ポジティブなChIPによる濃縮は、総inputクロマチンの0.5% (例:転写因子や補助因子) から40 - 50% (例:アセチル化・メチル化ヒストン) まで幅があります。Normal Rabbit IgG #2729を使用した際、磁気ビーズとアガロースビーズのバックグラウンドレベルは通常、総inputクロマチンの0.05 - 0.1%の範囲になります。
PCRの結果は、使用するPCRプライマーセットと抗体によっても異なります。実験は、PCRで適切に増幅され、得られたシグナルが本物であることを確認するために、適切なポジティブコントロールとネガティブコントロールを用いてデザインする必要があります。
ChIP-seqでは、ライブラリー構築やNGシーケンシングによって生じるバイアスを正規化するために、inputサンプルをネガティブコントロールとして使用することが可能です。inputサンプルは、IgGによるDNAプルダウンに比べて利点があります。なぜなら、調製に手間がかからず、より複雑なシーケンシングライブラリーの調製に十分なDNAが用意できるからです。
inputシーケンシングデータを正規化した後、転写因子およびそれらのコファクターの解析では、解析に十分なピーク数を同定する必要があります。一部のヒストン修飾とその補助因子は、いくつかの遺伝子の全体をカバーするゲノム領域に渡って、非常に幅広いピークを示します。この場合、定義されたブロードピークの数は、ブロードピークを定義する利用可能なプログラムに限界があるため、信頼性がありません。すべてのナローピークおよびブロードピークは、ゲノム全体に渡って許容可能なシグナルノイズ比を示さなければなりません。モチーフ解析は、既知の結合モチーフが、転写因子の抗体で得られたChIP DNAにおいて濃縮されているかを決定するために利用できます。
SimpleChIP® Control PCRプライマーは、ChIP実験とChIP抗体のための完璧なポジティブコントロールとネガティブコントロールとして利用可能です。キットに含まれている、ポジティブコントロール抗体Histone H3 (D2B12) XP® Rabbit mAb (ChIPFormulated) #4620と、ポジティブコントロールプライマーSimpleChIP® RPL30 primersを使用する場合、RPL30プロモーターの濃縮が、総inputクロマチンの2 - 4%になるようにする必要があります。ネガティブコントロールNormal Rabbit IgG #2729を用いたRPL30プロモーターのバックグラウンド濃縮は、総inputクロマチンの0.1%未満である必要があります。さらに、Histone H3は細胞におけるクロマチンの中核となる構成因子であり、ゲノム全体に渡ってほとんどのDNA配列と結合するため、Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) #4620は、実質的にはどのようなDNA座の研究でもポジティブコントロール抗体として使用することができます。
CSTでは、すべての当社ChIP検証済み抗体と一緒に使用する、ポジティブコントロールプライマーとネガティブコントロールプライマーを両方とも販売しています。これらは、CST抗体のChIPでの検証に使用するプライマーセットと同じものです。ポジティブコントロールプライマーセットは、特定のヒストン修飾を含むか、または特定の転写因子に結合することが示されている遺伝子座位を増幅し、一方、ネガティブコントロールプライマーセットは、特定の修飾または結合因子を含まない領域を増幅します。ある特定の遺伝子座位に結合するヒストン修飾や転写因子は、細胞の状況に基づいて変化する可能性があります。よって、調べたいヒストン修飾や転写因子の種類によっては、そのコントロールプライマーセットを使用する際に、ある特定の細胞タイプを用いたり処理を実施したりする必要があります。しかし、より一般的に、複数の細胞タイプで、複数の抗体に対するコントロールとして使用できるコントロールプライマーセットもあります。例えば、RPL30とGAPDHはほとんどの細胞タイプで活性化しているハウスキーピング遺伝子です。したがって、RPL30とGAPDHコントロールプライマーセットは、ほとんどの細胞タイプでの転写活性化に関連するようなヒストン修飾のポジティブコントロールとして使用することができます。同様に、α Satellite Repeat Control Primer #4486は恒常的なヘテロクロマチンの領域を増幅し、あらゆる細胞タイプの転写活性化と関連するヒストン修飾と転写因子のネガティブコントロールとして使用できます。
はい。追加で行うクロマチン処理、IP反応、DNA精製、PCR増幅用に、SimpleChIP® Chromatin IPキットの構成品で単品販売しているものを、以下の一覧に示します。
単品販売されていないキット構成品が必要な場合はご連絡ください。お客様のニーズに対して特注品でサポートさせていただくか、代替品をご提案させていただきます。
ご質問は、CSTのChIPグループ ([保護されたメール]) まで、直接お問い合わせください。
Christopher Fry, PhD
Associate Director of Epigenetics
Fang Chen, PhD
Chromatin IP Development Scientist
更新:2010年10月
改訂日:2017年7月