View in English?
View in English?
結果を得るまでに要する時間を短縮することは非常に重要です。お客様の貴重な時間をできるだけ節約するために、CSTは製品固有のプロトコールを厳密に試験・開発し、各抗体のIHCでの使用に最適な条件を検証しています。この条件は、抗原賦活化と免疫染色の複数の方法を試験することで、販売前に検討されています。さらに、抗原の検出感度を高め、IHCプロトコールの効果を向上させるための関連試薬も開発しています。
染色シグナルが適切に得られないなどでトラブルシューティングが必要な際、染色条件を少し変更するだけで解決できる事がよくあります。抗原賦活化のようなプロトコール内の重要ステップを変更すれば、多くの場合、このような一般的な問題は解決します。
免疫組織化学染色のコツとテクニック
免疫組織化学染色プロトコール
免疫組織化学染色 (IHC) で全く染色されない場合は、抗体やプロトコールに問題がある場合があります。抗体がIHCで検証されていることを確認の上、パラフィン包埋細胞ペレットなどの発現が高いポジティブコントロールを使用して、抗体やプロトコールが期待通りにワークしているかを確認してください。
特にリン酸化特異的抗体、または発現が稀なタンパク質を検出する抗体では、100%全ての検体で染色されないことがあります。このサンプルでは真に陰性 (発現していない) の可能性もあります。
IHC用のスライドは長期間保存するとシグナルが消失することがあります。この保存プロセスは調節可能で、タンパク質標的によります。染色に対するスライドの保存の影響がすべてのタンパク質で確立されているわけではありません。したがって、実験直前に作製した薄切したてのスライドを使用することをお勧めいたします。スライドを保存しなければならない場合は、4℃で保存してください。保存前にスライドをベーキングすることはお勧めできません。染色処理の間、組織切片は常に液体で覆われるようにしてください。
脱パラフィンが不十分だと、IHC実験で染色が斑状になったり、不均一なバックグラウンド染色の原因となることがあります。このような場合は、新しいキシレンを用い、別の新しい切片で脱パラフィンをやり直してください。
IHCで使用される固定済みの組織切片では、タンパク質間で化学的にクロスリンクされており、組織や標的にもよりますが、抗体のアクセスが阻害されたり標的がマスクされたりする可能性があります。抗原賦活化には、熱水浴、電子レンジ、または圧力釜を使用するプロトコールがあります。恒温槽を使用した抗原賦活化プロトコールはお勧めできません。特定の組織や標的の染色で圧力釜の使用が必要なことがありますが、基本的には電子レンジで実施する抗原賦活化をお勧めしています。
特定の組織や標的の染色で、最適化された賦活化バッファーが必要です。CSTは、推奨される抗原賦活化バッファー情報を含む最適化プロトコールを、製品データシートに記載しています。必ず新鮮な1X 溶液を毎回調製することも推奨しています。
CSTのすべてのIHC検証済み抗体に対する製品ごとに用意されたプロトコールは、こちらから検索してください。
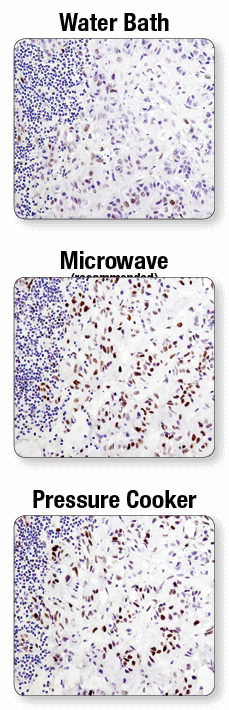
抗原賦活化には電子レンジの使用を推奨します。 ウォーターバス (上図)、電子レンジ (中央図)、または圧力釜 (下図) を使用して抗原賦活化した後、CSTのPhospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145を用いたパラフィン包埋ヒト肺がん組織のIHC結果を示します。電子レンジを使用した場合とウォーターバスを使用した場合で、結果に明確な差が認められます。なお、抗体の種類によっては、電子レンジよりも圧力釜を使用した方が染色強度が高くなる場合があります。
CSTは、各IHC検証済み抗体製品用に、推奨希釈率と希釈液の情報を含む最適化プロトコールを提供しています。推奨試薬以外の試薬を使用する場合は、抗体のタイトレーションが必要になることがあります。
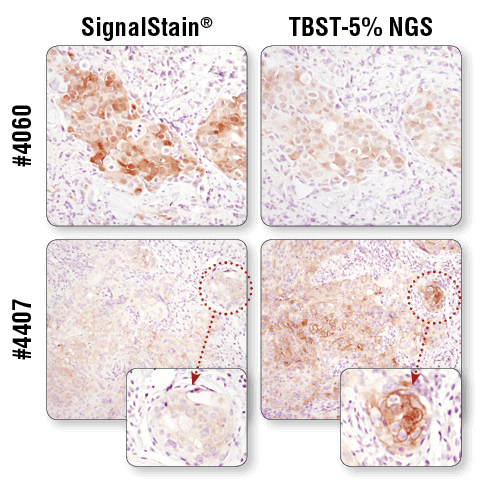
抗体の希釈には、製品のデータシートに記載されているCST推奨の一次抗体希釈液を必ず使用してください。 抗体の希釈にSignalStain® Antibody Diluentを用いた結果 (左) と、5%正常ヤギ血清含有TBSTを用いた結果 (右) を比較しました。上図はパラフィン包埋ヒト乳がん組織をPhospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060で染色した結果、下図はHCC827異種移植片をPhospho-EGF Receptor (Tyr1173) (53A5) Rabbit mAb #4407で染色した結果です。#4060では、5%正常ヤギ血清含有TBSTで希釈した結果に比べて、SignalStain® Antibody Diluentで希釈した場合に良好なシグナルが得られます。対照的に、#4407では、5%正常ヤギ血清含有TBSTで希釈した場合に良好な結果が得られます。それぞれの抗体の推奨希釈液は、製品のデータシートでご確認ください。
一次抗体のインキュベートについて十分に検証されたプロトコールを用いることで、一貫性と信頼性のある結果が得られます。CSTの抗体は、4°Cで一晩反応させることで最良の結果が得られるように開発、検証されています。
SignalStain® DAB Substrate Kit (#8059) との併用する、SignalStain® Boost IHC Detection Reagents (#8114) および (#8125) のようなポリマーベースの検出試薬は、アビジン/ビオチンベースの検出システムよりも感度が高くなります。HRPを直接標識した標準的な二次抗体を使用しても、十分にシグナルが増幅されない可能性があります。なお、使用前に検出試薬の有効期限は必ず確認してください。
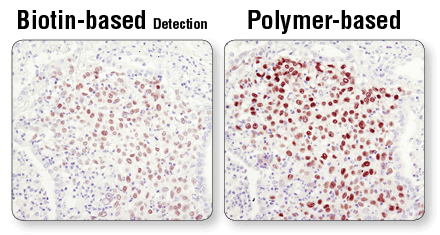
ポリマーベースの検出法は、ビオチンベースの検出法より高感度です。 パラフィン包埋ヒト肺がん組織切片に反応させたSox2 (D6D9) XP® Rabbit mAb #3579を、ビオチンベースの検出法 (左図) またはポリマーベースの検出法 (SignalStain® Boost IHC Detection Reagent #8114、右図) で可視化しました。ポリマーベースの方が感度が高く、より強いシグナルが得られることが分かります。
脱パラフィンが不十分だと、IHC実験で染色が斑状になったり、不均一なバックグラウンド染色の原因となることがあります。このような場合は、新しいキシレンを用い、新しい組織切片で実験をやり直してください。
HRPベースの検出システムを使用する場合は、組織サンプルの内因性ペルオキシダーゼ活性により、異常に高いバックグランドシグナルが生じる可能性があります。この場合は、一次抗体とのインキュベーションの前に、スライドを精製水 (RODI) で希釈した3% H2O2溶液中で10分間クエンチングしてください。
腎臓および肝臓組織のような高レベルの内因性ビオチンを持つサンプルでは、ビオチンベースの検出システムの使用が問題になる可能性があります。この場合、SignalStain® Boost IHC Detection Reagents (#8114) および (#8125) のようなポリマーベースの検出システムを使用してください。また、通常のブロッキングと一次抗体のインキュベーションの間に、ビオチンのブロッキングを行うことも可能です。
IHC実験で確実に十分なブロッキングを行うために、一次抗体反応の前に、5% Normal Goat Serum (#5425) を含む1X TBST (#9997) で30分間処理してください。
製品専用の推奨希釈率と希釈液は、データシートとすべてのIHC検証済み抗体の製品ページに記載されています。推奨試薬以外の試薬を使用する場合は、抗体のタイトレーションが必要になることがありますのでご留意ください。
試験されているサンプルと同じ動物種で作成された一次抗体を使用する場合、二次抗体が内因性IgGに結合し、Mouse-On-Mouse (MOM) 染色などの高いバックグラウンドを引き起こすことがあります。二次抗体がバックグラウンドの原因かどうかを確かめるために、一次抗体を用いずに染色するコントロールスライドを必ず含めるようにしてください。
解析標的に対するコントロールスライドをお探しの場合は、こちらをご覧ください。
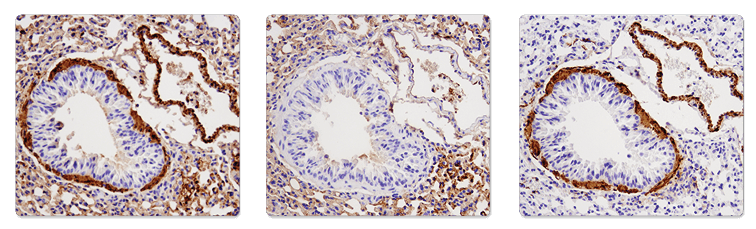
α-Smooth Muscle Actin (1A4) Mouse mAb (IHC Formulated) #56856 (左図)、SignalStain® Boost IHC Detection Reagent (HRP, Mouse) #8125 のみ (中央図)、またはα-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb #19245 (右図) を用いたパラフィン包埋マウス肺のIHC結果を示します。マウス組織と抗マウス二次抗体を使用した結果、MOMバックグラウンド、すなわち、マウス由来抗体をマウスの免疫組織染色に用いる時に問題となる高いバックグラウンドが発生しています (左図と中央図)。抗ラビット二次試薬 (SignalStain® Boost IHC Detection Reagent (HRP, Rabbit) #8114) はMOMバックグランド (右図) を排除します。
バックグラウンドを低く抑え、そしてシグナルを引き上げてコントラストを上げるためには、十分な洗いが重要です。一次抗体および二次抗体のインキュベーション後に、スライドをTBST (#9997) で各5分間、3回洗ってください。
コントロールスライドは、染色試薬やIHCプロトコールのパフォーマンスを確認できる貴重なツールです。各スライドには、ポジティブコントロールとネガティブコントロールとして、ホルマリン固定されたパラフィン包埋 (FFPE) 細胞ペレットがそれぞれ含まれています。