View in English?
View in English?
蛍光ウェスタンブロッティングを行う場合、TrueBlack® Fluorescent Western Blot Blocking Buffer Kit #40683を用いることを強く推奨します。本キットは、蛍光標識抗体とウェスタンブロッティング用メンブレンの非特異的な相互作用を防ぎ、蛍光ウェスタンブロットアッセイで特異性と感度が増加するように特別に調整されています。このため、標準的な抗体希釈液やブロッキングバッファーに比べ、TrueBlack® Fluorescent Western Blot Blocking Buffer Kitを用いることで、低バックグラウンドでより強い標的シグナルを得ることができます。本キットを使用する場合は、製品ウェブページまたはデータシートに記載されているキットの専用プロトコールに従ってください。
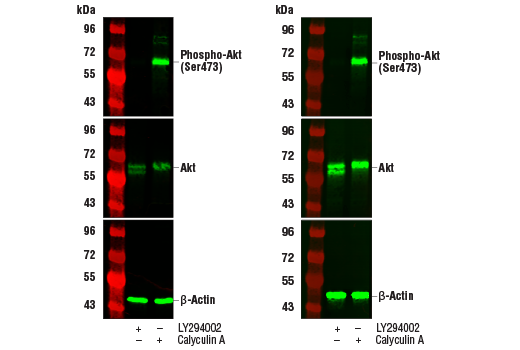
LY294002 #9901またはCalyculin A #9902で処理した (+)、もしくは未処理 (-) のJurkat細胞から細胞抽出物を調製し、Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060 (上段)、Akt (pan) (C67E7) Rabbit mAb #4691 (中段)、 β-Actin (D6A8) Rabbit mAb #8457 (下段) を用いたウェスタンブロッティングで解析しました。ウェスタンブロッティング用メンブレンを、弊社の標準的な抗体希釈液とブロッキングバッファー (左) またはTrueBlack® Fluorescent Western Blot Blocking Buffer Kit (右) で処理しました。TrueBlack® Fluorescent Western Blot Blocking Buffer Kitを用いた場合、抗体感度の増加とバックグラウンド蛍光の低減が観察されました。
注意:二色同時検出のウェスタンブロッティングでは、異なる種の一次抗体と、異なる色素で標識した適切な二次抗体が必要です。エピトープのオーバーラップは干渉を生じることがあり、2重蛍光ウェスタンブロットではこれを考慮する必要があります。一次抗体のインキュベーションバッファーが異なる場合は、一次抗体を両方のバッファーで別々にテストし、同時検出に最も適したバッファーを特定してください。
転写膜と一次抗体を静かに振盪しながら、4℃で一晩反応させてください。一次抗体の希釈液として、0.1% Tween® 20含有1X TBSを用いて、5% (w/v) に溶解したBSAあるいは脱脂粉乳を使用します。一次抗体の希釈バッファーと希釈率は、一次抗体の製品ウェブページを参照してください。
注意:溶液は、逆浸透脱イオン (RODI) 水、または同等の精製水で調製してください。
SDS-PAGEゲル (10 cm × 10 cm) に20 µLをアプライし、電気泳動してください。
注意:電気泳動確認と分子量決定のために、プレステイン分子量マーカー (#59329、10 µL/lane) もアプライして電気泳動することをお勧めします。着色マーカーは近赤外波長の自家蛍光があります。
注意:10 cm × 10 cm (100 cm2) の転写膜用の必要量を記載しています。サイズの異なる転写膜をご使用の際は、適宜量を調節してください。
転写膜を室温で1時間、ブロッキングバッファー25 mL中でインキュベートしてください。
重要なステップ:ブロッキングバッファーにはTween® 20を入れないでください (セクションA、ステップ8)。
余分なTBSTを除去し、転写膜を乾かしてください。
重要なステップ:蛍光染色のために転写膜は乾燥させる必要があります。
更新:2022年3月
改訂日:2022年3月