View in English?
View in English?
多くの場合、適切なコントロールや生化学的処理、条件などを検討して実験計画を練ることが、より良い結果を得るための最初のステップとなります。ウェスタンブロット実験デザインの詳細は、WB実験デザインのヒントをご確認ください。
ご興味のあるトラブルシューティングのトピックを選択してください:
| 問題 | 考えられる原因 | 推奨される対処法 |
|---|---|---|
|
シグナルが低いまたは検出されない |
過去に希釈した抗体を再利用した |
希釈後の抗体は安定性が低く、古い希釈バッファーは微生物や真菌に汚染されやすいため、希釈した抗体の再利用は推奨しません。最適な結果を得るため、毎回新たに希釈した抗体を使用することを推奨します。 |
|
組織や細胞株におけるタンパク質の発現が低い |
BioGPSやThe Human Protein Atlasなどの発現プロファイリングツールや科学文献などを用いて、使用する細胞や動物組織が目的のタンパク質を十分に発現することが期待できるかどうかを確認することを推奨します。実験結果の確認のため、常に既知のポジティブコントロールを置くことを推奨します。実験コントロール調製法に、多くのCST抗体に推奨されるコントロールの一覧が記載されています。 全細胞抽出物や全組織抽出物中に含まれる総標的タンパク質/未修飾標的タンパク質を検出する場合は、1レーン当たり少なくとも20 - 30 µgのタンパク質をロードすることを推奨します。しかし、全組織抽出物中の修飾された標的 (リン酸化や切断など) を検出する場合は、ロードする全タンパク質量を1レーン当たり100 µgまで増やす必要があることもあります。組織中のごく一部の細胞に翻訳後修飾を受けた標的が含まれる場合は、より多くのタンパク質のロードが必要な可能性もあります。タンパク質の分解を防ぎ、タンパク質の収量を維持するために、細胞抽出物にプロテアーゼ阻害剤やホスファターゼ阻害剤を加えることが不可欠です。プロテアーゼ阻害剤として、溶解バッファーにLeupeptin (終濃度1.0 µg/mL) やPMSF (#8553) を加えることを推奨します。Protease Inhibitor Cocktail (100X) (#5871) やProtease/Phosphatase Inhibitor Cocktail (100X) (#5872) をご利用いただくこともできます。 |
|
|
リン酸化タンパク質や修飾タンパク質の発現レベルが低い |
多くの場合、未処理の細胞株や組織に発現する翻訳後修飾タンパク質の基底レベルは低いです。PhosphoSitePlusを利用するなどして特定の修飾部位の参考文献を調べたり、コントロール調製法を利用してポジティブコントロールとして機能する細胞や組織とその処理法の例を調べることを推奨します。 タンパク質の分解を防ぎ、タンパク質の収量を維持するために、細胞抽出物にプロテアーゼ阻害剤やホスファターゼ阻害剤を加えることが不可欠です。セリン/スレオニンキナーゼホスファターゼ阻害剤として、溶解バッファーにピロリン酸ナトリウム (終濃度2.5 mM) やβ-グリセロリン酸 (終濃度1.0 mM) を加えてください。チロシンホスファターゼ阻害剤として、オルトバナジン酸ナトリウム (終濃度2.5 mM) を加えてください。Protease Inhibitor Cocktail (100X) (#5871) やProtease/Phosphatase Inhibitor Cocktail (100X) (#5872) をご利用いただくこともできます。 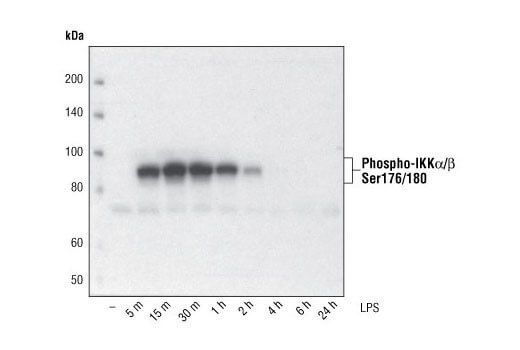
|
|
|
分泌タンパク質 |
標的タンパク質の中には細胞外に分泌されるものもあり、全細胞抽出物では信頼性の高い検出ができない場合があります。細胞培地からアセトンで沈殿させたり、培地を濃縮することで分泌された標的を検出できます。場合によっては、Brefeldin A (#9972) などの化学調節剤を用いて目的タンパク質の細胞外への分泌を抑制することもできます。 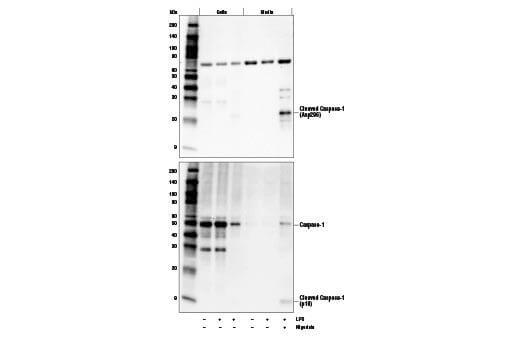
|
|
|
抗体の感度と反応性 |
抗体のウェブページで、感度/反応性のセクションを必ずご確認ください。トランスフェクションのみ (Transfected-only)、あるいは組換えタンパク質のみ (Recombinant-only) の抗体は、内因性レベルの標的を検出するのに十分な感度がありません。感度が内因性 (Endogenous) の抗体は、全てのタイプのサンプル (内因性、トランスフェクション、組換えタンパク質) に対応します。また、サンプル中の標的タンパク質の存在量に応じて、使用する抗体の量を増減させることで最適なシグナルが得られる場合があります。製品のウェブページやデータシートに記載されている希釈率を出発点として、最適化を行うことを推奨します。 もう1つの検討事項として、抗体の種交差性が挙げられます。製品ウェブページの反応性のセクションに記載されている生物種は、CSTの社内検証が実施されたものです。記載の無い生物種については、テクニカルサポートにお問合せください。お客様のモデル生物種のタンパク質の配列から、抗体の反応性を予測することができます。 |
|
|
溶解が不完全である |
CSTは使用する溶解バッファーのタイプに依らず、完全に溶解し、最大かつ一貫したタンパク質の回収を行うため、ソニケーションを推奨しています。ソニケーションは、膜結合型タンパク質やオルガネラ (核やミトコンドリアなど) 局在性の標的を効率的に抽出するために不可欠で、SDS-PAGEのゲルにロードする際の障害となる核DNAを剪断する役割もあります。最適なサンプル調製には、プローブ式のソニケーターを推奨します。1 mLのサンプルの場合、マイクロチップソニケーターを用い、15W (または出力50%) で、3 x 10秒間の破砕を氷上で行うことを推奨します。代替法として、細い注射針 (24Gなど) を繰り返し通過させたり、ガラスビーズを加えてボルテックスする方法もあります。ソニケーションの後、サンプルを遠心分離して不溶性の細胞片をペレット化し、その上清をウェスタンブロッティングに使用することができます。 |
|
|
バッファーが最適ではない |
それぞれの抗体で最適な結果を得るため、製品ウェブページからウェスタンブロッティングのプロトコールを確認し、推奨されている一次抗体の希釈バッファー (BSA or 脱脂粉乳) を使用してください。推奨希釈バッファーを使用してインキュベートしなかった場合、結果の感度や特異性が著しく損なわれることがあります。例えば、多くのCST抗体の場合、一次抗体のインキュベーションに脱脂粉乳は条件が厳し過ぎます。一般に、CSTはブロッキングと二次抗体のインキュベーションに5%脱脂粉乳を含む1X TBS/0.1% Tween-20を推奨しており、非特異的なバックグラウンドを最小限に抑えています。ゼラチン、血清、タンパク質不含ブロッキング剤、カゼイン、あるいは混合ブロッキング剤のような代替ブロッキング剤を使用すると、標的シグナルの強度が低減することがあります。 リン酸化タンパク質を検出する場合に、希釈バッファーに脱脂粉乳を使用することを懸念するお客様が多くいらっしゃいます。具体的には、脱脂粉乳に含まれるカゼインが高いバックグラウンドの原因になると考えられています。CSTでは、リン酸化タンパク質の検出に脱脂粉乳を使用することで、問題はみられていません。全てのCST抗体は販売前に5%脱脂粉乳と5%BSAの両方で試験を行い、最適な希釈バッファーを選択して推奨バッファーとしています。 ブロッキング、抗体インキュベーション (一次抗体および二次抗体)、洗浄には、全て1X TBS/0.1% Tween-20をベースとしたバッファーを使用してください。Tween-20の割合が高すぎる場合や低すぎる場合には、結果の感度や特異性が損なわれることがあります。CST抗体の一部は、TBSではなくPBSを使用するとシグナル強度が低下する場合があります。 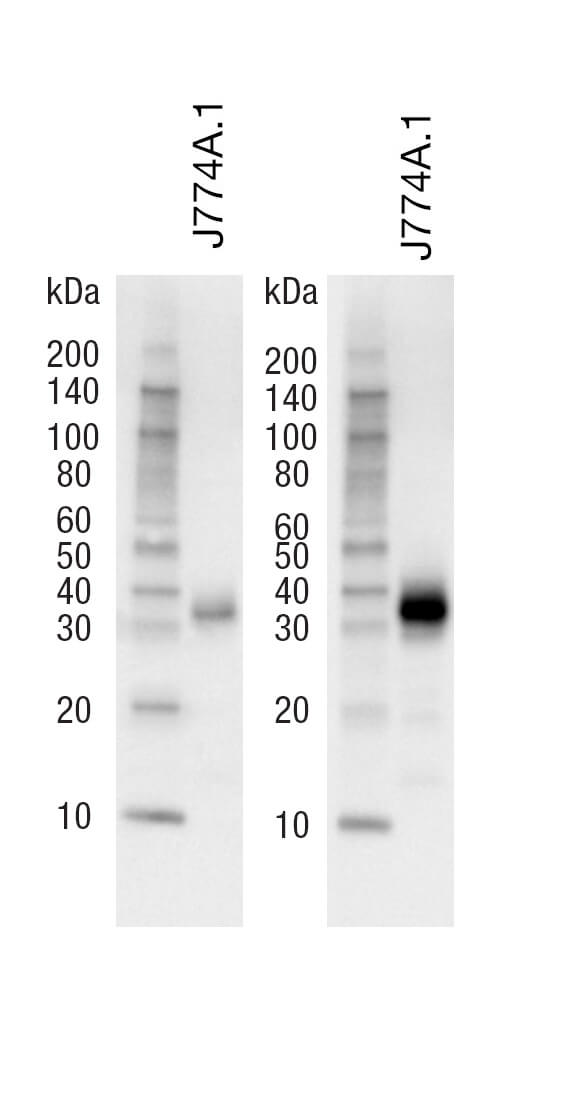
|
|
|
転写条件が最適ではない |
一般的にウェット式転写装置を用い、25 mMトリス、192 mMグリシン、20%メタノールを含むバッファーに浸して、4°C、2時間、70 V (200 - 250 mA) で転写することを推奨しています。しかし、高分子タンパク質の場合は、転写バッファーのメタノール濃度を5 - 10%まで下げ、70 V (200 - 250 mA) で3 - 4時間 (200 - 250mA) 転写することを推奨します。セミドライ式転写装置を使用する場合は、装置の製造元の推奨条件に従ってください。 低分子タンパク質の場合は、過剰な転写、いわゆる小さな標的の「吹き抜け」を防ぐことが重要です。低分子量タンパク質 (25 - 30 kDa未満) の欠落を最小限に抑えるため、転写時間を短縮することと、ポアサイズが0.2 µmのニトロセルロース転写膜を使用することを推奨します。 |
|
|
複数のバンドが検出される、または非特異的な結合がみられる |
アイソフォームの反応性 |
細胞株や組織モデルによっては、複数のタンパク質アイソフォームやスプライシングバリアントを含むものがあり、移動度の異なる様々な分子量として検出されることがあります。複数のアイソフォームの検出が予想される、あるいは確認されているかどうかは、抗体のウェブページのSpecificity/Sensitivityのセクションを参照してください。また、UniProtで標的タンパク質を検索し、複数のアイソフォーム配列が記載されているかどうかを確認することもできます。 |
|
翻訳後修飾 (PTM) |
翻訳後修飾 (PTM) によって、標的タンパク質の一部の移動度が未修飾のタンパク質に比べて変化する場合があります。したがって、ある種の翻訳後修飾の誘導や阻害をする条件で処理すると、ウェスタンブロットで複数のバンドがみられることがあります。このように、使用するサンプルや処理によって、ウェスタンブロットで複数のバンドが現れる翻訳後修飾の例として、グリコシル化、SUMO化、ユビキチン化、リン酸化などが挙げられます。PhosphoSitePlusをご覧いただくことで、標的タンパク質のPTMの詳細情報を確認することができます。 |
|
|
組織サンプル |
組織サンプルは不均一である (すなわち、様々なタイプの細胞で構成されている) ため、細胞株など、その他のタイプのサンプルでは検出されない非特異的なバンドが、抗体で検出される可能性が高くなります。また、組織モデルによっては、複数のタンパク質アイソフォームやスプライスバリアントを含む場合があり、これらが移動度の異なる様々な分子量で検出されることがあります。 |
|
|
ライセートが分解されている |
サンプルに含まれるのプロテアーゼやホスファターゼは、タンパク質を迅速に分解します。ライセートにプロテアーゼ阻害剤やホスファターゼ阻害剤を加えることで、タンパク質の分解を遅延させたり、防ぐことができます。プロテアーゼ阻害剤として、溶解バッファーにLeupeptin (終濃度1.0 µg/mL) やPMSF (#8553) を加えることを推奨します。Protease Inhibitor Cocktail (100X) (#5871) やProtease/Phosphatase Inhibitor Cocktail (100X) (#5872) をご利用いただくこともできます。 また、時間の経過によってライセート中のタンパク質分解が進行し、抗体によって分解産物が検出されるようになる場合もあります。タンパク質分解を最小限に抑えるため、新鮮なサンプルを使用するようにしてください。同じバイアル中でも、他のタンパク質に比べて安定性の低いタンパク質もあり、ある標的タンパク質は問題なく検出できても、他のタンパク質はすでに分解されている可能性もあるのでご注意ください。 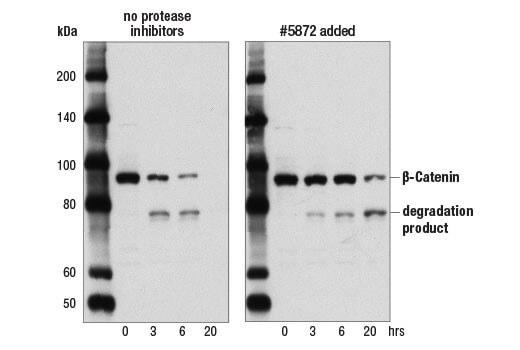
|
|
|
タンパク質濃度が高すぎる |
感度の高い抗体を使用した場合、転写膜上に過剰なタンパク質が存在すると、複数のバンドや高いバックグラウンド、少量のタンパク質ではみられないようなレーン全体にわたる強いシグナルが現れることがあります。ロードするタンパク質量を減らすことで、より明瞭なシグナルが得られる場合があります。 |
|
|
露光時間が長すぎる |
特に使用したサンプルに含まれる目的タンパク質の量が少ない場合、ロードしたタンパク質の量が少なすぎると検出が困難になります。このため、標的タンパク質の検出のため、露光時間を長くする必要性が生じます。CST抗体は、一般的なECL試薬で2分以内の露光時間でシグナルが得られるように調製されています。この時間内にシグナルが得られない場合は、タンパク質濃度を上げることで結果が改善されることがあります。 |
|
|
一次抗体の希釈バッファーが最適ではない |
一次抗体の希釈に使用するバッファーは、転写膜のバックグラウンドに影響を与えることがあります。例えば、脱脂粉乳を含むバッファーはBSAに比べて非特異的なバンドやブロット全体のバックグラウンドを効率的に減少させます。しかし、脱脂粉乳では条件が厳しすぎて標的のシグナルが低下してしまう抗体もあります。製品ウェブページからウェスタンブロッティングのプロトコールを確認し、適切な一次抗体の希釈バッファー (BSA or 脱脂粉乳) を使用することが重要です。一般に、CSTはブロッキングと二次抗体のインキュベーションに5%脱脂粉乳を含む1X TBS/0.1% Tween-20を推奨しており、非特異的なバックグラウンドを最小限に抑えています。 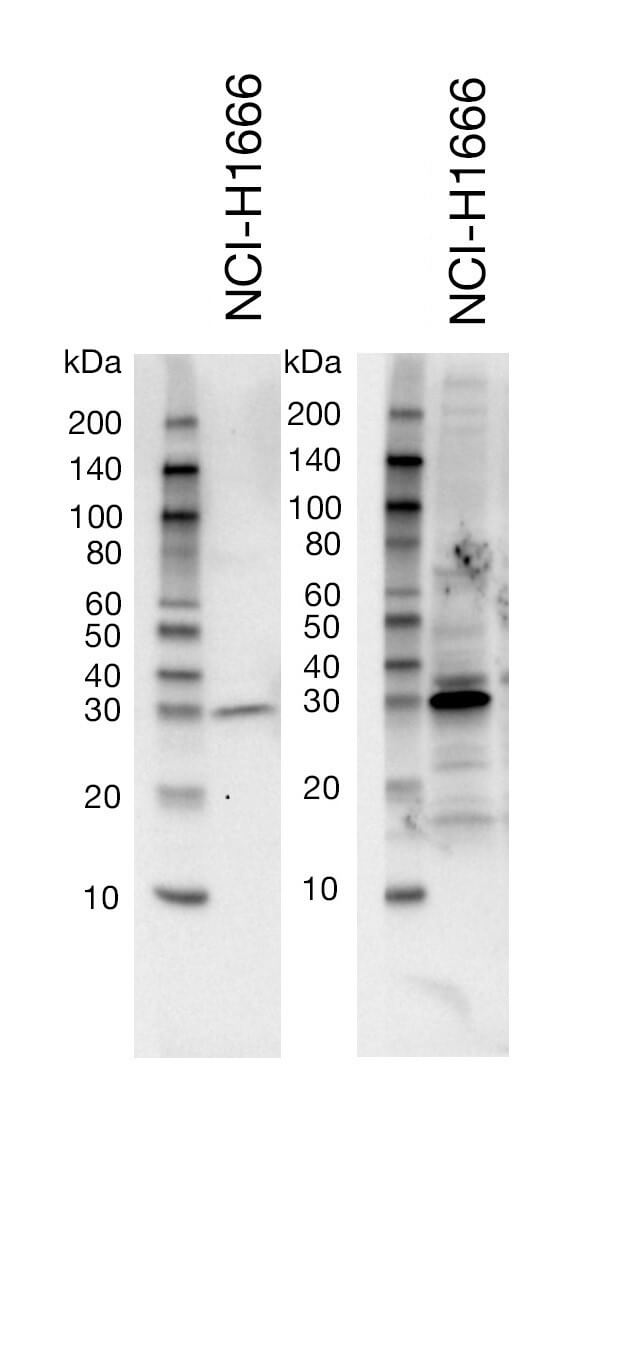
|
|
|
スメアがみられる |
タンパク質のグリコシル化 |
グリコシル化の違いによって、予想されるより高分子にバンドのスメアがみられることがあります。PhosphoSitePlusをご覧いただくことで、標的タンパク質のグリコシル化候補部位を確認することができます。また、糖タンパク質からN-結合型糖鎖を切断する酵素PNGase Fでサンプルを処理することで、グリコシル化による分子量の変化を確認することができます。 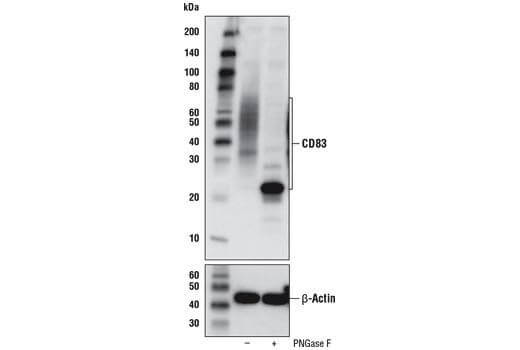
|
|
ライセートが分解されている |
サンプルに含まれるのプロテアーゼやホスファターゼは、タンパク質を迅速に分解します。ライセートにプロテアーゼ阻害剤やホスファターゼ阻害剤を加えることで、タンパク質の分解を遅延させたり、防ぐことができます。溶解バッファーには、プロテアーゼ阻害剤としてLeupeptin (1.0 ug/ml最終濃度) およびPMSF (#8553) を含めることが推奨されます。Protease Inhibitor Cocktail (100X) (#5871) やProtease/Phosphatase Inhibitor Cocktail (100X) (#5872) をご利用いただくこともできます。 また、時間の経過によってライセート中のタンパク質分解が進行し、抗体によって分解産物が検出されるようになる場合もあります。これが予想されるより低分子量のスメアとして現れることがあります。タンパク質分解を最小限に抑えるため、新鮮なサンプルを使用するようにしてください。ライセートの長期保存が必要な場合は、-80°Cで保存し、分解を最小限に抑えることを推奨します。同じバイアル中でも、他のタンパク質に比べて安定性の低いタンパク質もあり、ある標的タンパク質は問題なく検出できても、他のタンパク質はすでに分解されている可能性もあるのでご注意ください。 |
|
|
溶解が不完全である |
CSTは使用する溶解バッファーのタイプに依らず、完全に溶解し、最大かつ一貫したタンパク質の回収を行うため、ソニケーションを推奨しています。ソニケーションは、膜結合型タンパク質やオルガネラ (核やミトコンドリアなど) 局在性の標的を効率的に抽出するために不可欠で、SDS-PAGEのゲルにロードする際の障害となる核DNAを剪断する役割もあります。最適なサンプル調製には、プローブ式のソニケーターを推奨します。1 mLのサンプルの場合、マイクロチップソニケーターを用い、15W (または出力50%) で、3 x 10秒間の破砕を氷上で行うことを推奨します。代替法として、細い注射針 (24Gなど) を繰り返し通過させたり、ガラスビーズを加えてボルテックスする方法もあります。ソニケーションの後、サンプルを遠心分離して不溶性の細胞片をペレット化し、その上清をウェスタンブロッティングに使用することができます。 |
|
|
暗く黒いブロットがみられる |
二次抗体の濃度が高すぎる |
高感度の検出試薬 [例えばCSTのSignalFire™ Elite ECL Reagent (#12757)] を用いた場合などに、使用した二次抗体 (すなわち、HRP: Horseradish peroxidase) が多過ぎると、黒いブロットや、白抜けした「ゴースト」バンドがみられることがあります。このような場合、HRP標識した二次抗体の希釈率を上げる (例えば、1:2000から1:10,000) ことで対処することができます。 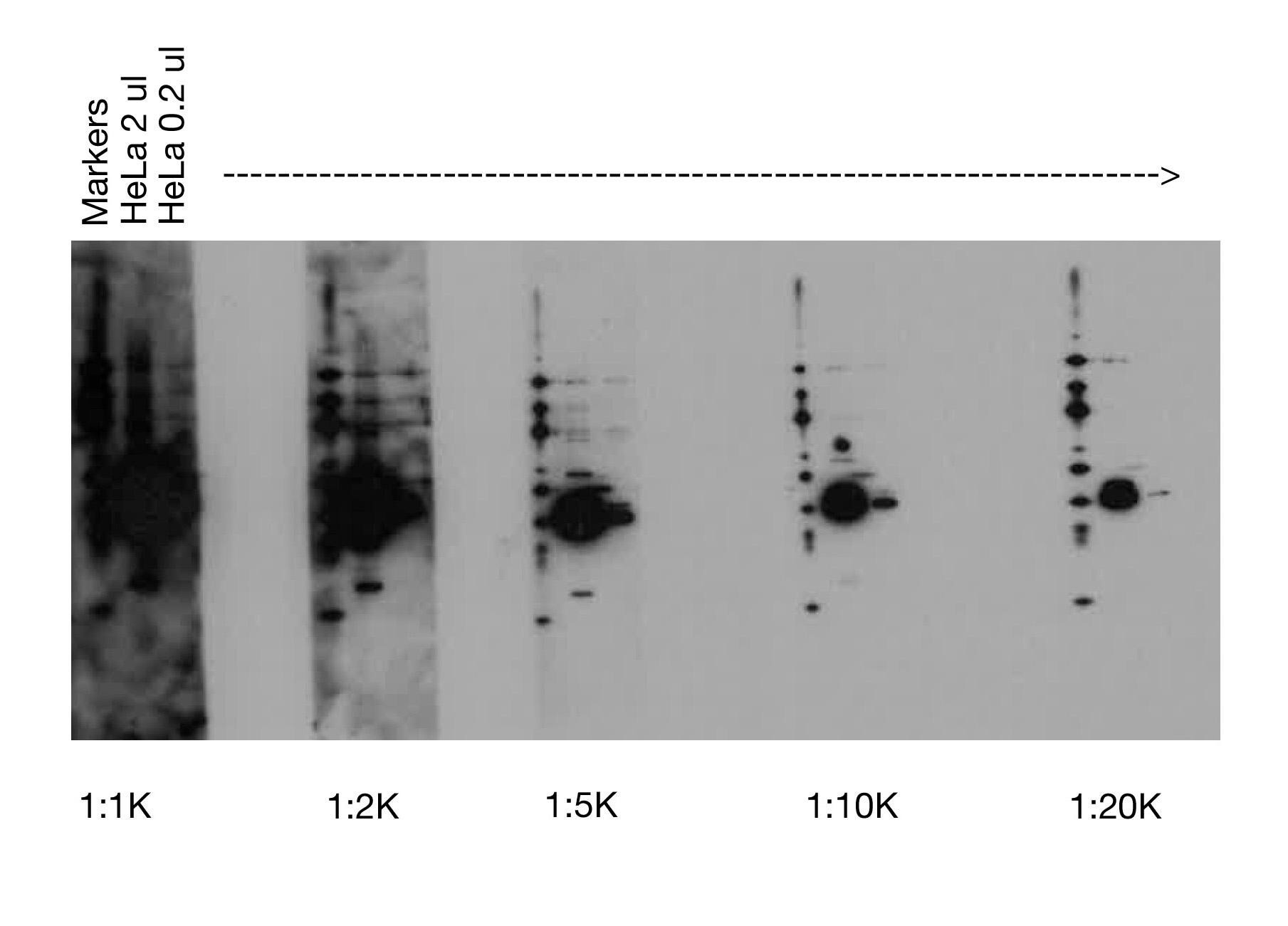
|
|
洗浄が不十分である |
洗浄時間を短くすると、転写膜に残った余剰の抗体により、化学発光の露光で暗いブロットの原因となることがあります。最適な結果を得るため、CSTは一次抗体のインキュベーション後と二次抗体のインキュベーション後に、1X TBS/0.1% Tween-20を用いて室温で5分間、3回の洗浄を行うことを推奨します。 |
|
|
バッファーが最適ではない |
使用するブロッキングバッファーや界面活性剤の有無は、転写膜のバックグラウンドに影響します。例えば、脱脂粉乳を含むバッファーはBSAに比べて非特異的なバンドやブロット全体のバックグラウンドを効率的に減少させます。しかし、脱脂粉乳では条件が厳しすぎて標的のシグナルが低下してしまう抗体もあります。製品ウェブページからウェスタンブロッティングの推奨プロトコールを確認し、適切な一次抗体の希釈バッファー (BSA or 脱脂粉乳) を使用することが重要です。一般に、CSTはブロッキングと二次抗体のインキュベーションに5%脱脂粉乳を含む1X TBS/0.1% Tween-20を推奨しており、非特異的なバックグラウンドを最小限に抑えています。 |
|
|
転写膜の再水和 |
最適なパフォーマンスを得るために、ニトロセルロース膜を直接転写バッファーで再水和することを推奨します。しかし、PVDF膜を用いる場合は、メタノールで短時間再水和した後、転写バッファーに移す必要があります。 |
|
|
斑点状の染みのようなブロットがみられる |
転写に用いるスポンジが汚染されている |
衛生的な扱いが不十分な古い転写用スポンジでは、細菌が繁殖している場合があります。この要因を排除するため、転写に用いるスポンジは新しいものを使用してください。 |
|
バッファーが汚染されている |
数日以上経過したバッファー中では、混入した細菌やカビが繁殖し、転写膜に斑点状の染みができる原因となることがあります。最適な結果を得るため、常に新鮮なバッファーを使用することを推奨します。 |