View in English?
View in English?
フローサイトメトリーは蛍光の検出をベースにしたアッセイであり、溶液に懸濁した細胞から細胞数や個々の細胞が発現するタンパク質量などの複数のパラメーターを同時に測定することができます。細胞の特性を表すパラメーターを定量的に、迅速かつ正確に読み取ることができる強力な研究ツールで、不均一な細胞集団から個々の細胞の情報を得ることができます。
フローサイトメトリーでは、細胞懸濁液を細く流して、一列に並んだ細胞が順次光源を通過するように調整し、個々の細胞が通過した際の光源の散乱や発する蛍光を様々な波長で計測する装置を用います。励起波長や蛍光波長の異なる蛍光分子を組み合わせて使用することで、1つの細胞から同時に複数のパラメーターを読み取ることができます。細胞の特定の構成成分に結合する蛍光分子を用いる場合と、特定のタンパク質やその翻訳語修飾を認識する抗体を蛍光標識して使用する場合があります。
フローサイトメトリーは、単一標的を検出するだけのシンプルな解析から、免疫表現型解析やシグナル伝達解析といった複雑な解析にまで応用できる、非常に用途の広い手法です。フローサイトメトリーは、細胞懸濁液を調製して光源を通過させるため、元々単一細胞が懸濁された状態の生体サンプル (白血球など) の解析に適しています。しかし、接着細胞や固形組織の場合も細胞同士を十分に解離させ、単一細胞の懸濁液を調製することで解析することができます。
フローサイトメトリーは単一細胞レベルでの定量的情報を必要とする実験に理想的な手法で、細胞レベルや細胞集団レベルの理解を深めることができます。定量的に得られるデータの例として、ある特定のタイプの細胞数、そのタイプの細胞が発現する特定のタンパク質の量、そのタンパク質の機能的な活性などが挙げられます。フローサイトメトリーでは、このような複数の情報を同時に得られるため、単一細胞ごとにこれらの情報の相関関係を解析することもできます。
個々の細胞の情報が保持される点が、細胞の集団から得られる情報を不可逆的に混ぜ合わせてしまうウェスタンブロブロッティングなどと大きく異なります。例えば、3種類の免疫細胞において、ある生物学的処理に対して2つの主要なシグナル伝達経路がどのように変化するか、というような複雑な情報もフローサイトメトリーでは容易に得ることができ、単一サンプルを標識して解析するだけの数時間で作業を終えることができます。ウェスタンブロットで同様の解析を行う場合は複数のサンプルと数日の作業が必要になります。
ただし、生物学的に重要な情報のすべてがフローサイトメトリーだけで得られるわけではありません。例えば、フローサイトメトリーでは細胞どうしの接着を解離させ、懸濁液を調製する必要があるため、組織内での配置などの空間的な情報を得ることができません。このような解析には免疫組織化学染色または組織ベースの免疫蛍光染色が有効です。細胞内局在など、ごくミクロなスケールでの解析では蛍光を利用した全視野顕微鏡、共焦点顕微鏡による解析が適していますが、組織レベルのスケールでの解析には、近年、イメージングサイトメーター技術が急速な進歩を遂げています。遺伝子変異や大規模なmRNA解析は、シーケンシング機器を用いた解析が有効です。しかし、細胞レベルの迅速な定量解析において、フローサイトメトリーに匹敵する手法はほとんどありません。
細胞生物学研究におけるフローサイトメトリーの一般的な利用法は、サンプルに含まれるの細胞のタイプの特定と定量化です。細胞の特定は、異なるタイプの細胞が細胞表面に異なるタンパク質を発現することを利用して行います。抗体が特定のタンパク質を特異的に認識して結合することを利用し、細胞を他のタイプの細胞と区別するために色を標識します。
このプロセスは免疫表現型解析として知られ、不均一な細胞集団に含まれる細胞のタイプの数と割合を知ることができます。免疫系を構成する細胞は、血中に懸濁されて存在しており、また、細胞のタイプを同定するための表面マーカーの特定も進んでいるため、免疫表現型解析がよく利用されます。
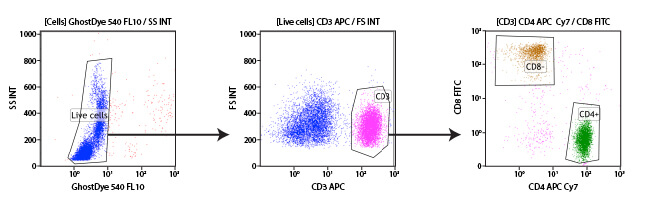
免疫表現型解析には蛍光色素で標識した抗体を用います。異なるタンパク質を標的とする抗体を異なる蛍光色素で標識することで、フローサイトメーターでこれらを同時に解析することができます。複数の抗体で同時に多重染色する解析は、マルチプレックス解析とも呼ばれます。マルチプレックス解析は2種の抗体を用いたものから、より多くの抗体で同時解析するものまであります。免疫表現型解析では、解析に利用する抗体の選択次第で1つのサンプルからT細胞、B細胞、単球など複数のタイプの免疫細胞を同時に特定することができます。
フローサイトメトリーは処理がとても速く、1秒当たり何千もの細胞を定量解析することができるので、免疫表現型解析に適した手法です。実験設定も30分以内に終えることができ、サンプルの標識から解析の実行、実験結果の取得まで、1度のアッセイを1時間以内に終えることもできます。同様の解析をウェスタンブロッティングで行う場合は、まず異なる細胞集団を別個に調製あるいは分取するステップが必要で、抗体ベースの濃縮操作などが必要になります。これにはより長時間の煩雑な操作が必要となり、また単一細胞レベルの情報を得ることもできません。
フローサイトメトリーによる免疫表現型解析のもう1つの利点は、生細胞を解析に用いることができることです。このため、解析後の細胞を解析結果に応じて特定の細胞集団ごとに分取することも可能です。解析のみに特化した装置と区別して、このような分取機能を備えた装置をセルソーターと呼びます。
フローサイトメーターで測定した細胞の特性をもとに、リアルタイムで細胞を物理的に別々の容器に分取 (ソーティング) することができます。このプロセスには特別なフローサイトメーター (セルソーター) が必要であり、FACS (fluorescence activated ell sorting) と呼ばれます。単一の蛍光強度の情報、あるいは複数の蛍光強度の情報を組み合わせて分取する細胞を定義し、特定の容器に取り分けます。細胞ごとの蛍光の情報は、細胞を抗体で蛍光標識するか、細胞に蛍光タンパク質を発現させることで得られます。細胞表面に露出した免疫表現型マーカーは、細胞を透過化処理することなく生きたまま標識できるので、FACSでよく利用されます。分取した細胞を続けて実験に用いることができる点が、FACSの大きな利点です。
最も重要な生物学的プロセスの大多数は、細胞内で起こっています。つまり、細胞表面上のタンパク質を測定して細胞のタイプを分類することができますが、これに対して細胞内タンパク質の量や活性を測定することで細胞プロセスの多くを知ることができます。したがって、細胞内タンパク質を定量解析することで、細胞プロセスの細胞生物学的なメカニズムの知見が得られ、病態における異常を発見することも期待できます。
個々のタンパク質は量的制御だけで生物学的活性が制御されているわけではありません。細胞表面の受容体からのシグナルや細胞内因性の要因で活性化されたシグナルを伝達する場合、タンパク質の翻訳語修飾 (PTM) がその手段としてよく利用されています。PTMはタンパク質を定義するる遺伝子にはコードされておらず、翻訳語に起こるタンパク質の質的変化です。PTMは通常、タンパク質の単一アミノ酸残基上に起こり、リン酸、アセチル基、メチル基などの低分子が付加されます。このほか、ユビキチンなどの小さなタンパク質の付加や、特定のアミノ酸配列で起こるタンパク質の切断もPTMに含まれます。
PTMは多くの場合、タンパク質の活性、安定性、機能などを変化させます。リン酸化は、細胞シグナル伝達カスケードの中で最もよく研究されている修飾です。リン酸化プロセスでは通常、タンパク質内のセリン、スレオニン、チロシン残基にリン酸基が付加されます。このアミノ酸のリン酸化は、時には同時発生する他のリン酸化イベントと協調し、多くの場合、タンパク質の機能に変化をもたらします。酵素のリン酸化は酵素のスイッチをオンにする役割を果たし、活性化した酵素が特異的な基質に作用するようになります。その酵素の機能の例としては、一連の標的タンパク質をリン酸化し、細胞内の機能を有効化または無効化することがあります。リン酸化の利点は、主要な機能タンパク質を予め合成し、その機能が必要になるまで待機状態に保持する機構を細胞が備えることにあります。動的なシグナル伝達に応答し、機能タンパク質を新たに合成することなく、スイッチの切り替えのみで迅速に活性を制御することができます。
抗体は高い特異性をもち、特定のアミノ酸残基がリン酸化されたタンパク質のみに結合する抗体を設計することもできます。特定のアミノ酸残基がリン酸化された場合のみに活性化するタンパク質の場合、そのリン酸化のレベルをそのまま活性の指標として利用することができます。このようなリン酸化を特異的に認識する抗体はリン酸化特異的抗体と呼ばれ、実験処理が細胞の生物学的活性に及ぼす影響を解析する強力なツールとして利用されています。また、これらは治療薬の候補化合物を検索する「ディスカバリー」ステップ (生物学的プロセスを特異的に変化させる化合物を発見するステップ) で利用することもできます。
リン酸化イベントは、リン酸化特異的抗体を用いたフローサイトメトリーによって簡便に検出することができます。フローサイトメトリーは細胞レベルのデータを高感度に高い定量性をもって検出することができ、細胞集団のリン酸化解析に適した手法と言えます。この技法は生細胞フローサイトメトリーと区別するために、「リン酸化フロー」と呼ばれます。この区別の理由は、タンパク質のリン酸化は、細胞膜近傍で起こる場合であっても、ほとんどすべてが細胞内で起こるからです。このため、リン酸化抗体を使用する場合は、抗体が細胞膜を通過して細胞内の標的に到達できるようにプロトコールを作成する必要があります。さらに、細胞が生物学的活動を止めた後、実験操作中にリン酸化レベルが変化するのを防ぐため、細胞を固定する必要があります。固定や透過化の操作は、生細胞フローサイトメトリーでは行いませんが、工程は簡単です。また、細胞内のリン酸化や一般的なタンパク質レベルを解析するために、特別なフローサイトメーターは必要はありません。
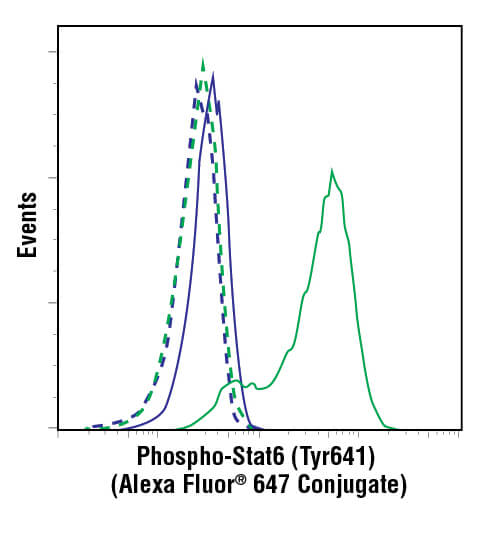
フローサイトメトリーで使用される機器はフローサイトメーター、あるいは「サイトメーター」と呼ばれます。フローサイトメーターは、細胞を取り扱うための流路系と、シグナル検出器およびデータ取得のためのプロセッサーを含む、光学系から成り立っています。FACS用に設計された機器には細胞分取を行う部分もあり、細胞が異なる捕捉容器に向かうようにします。
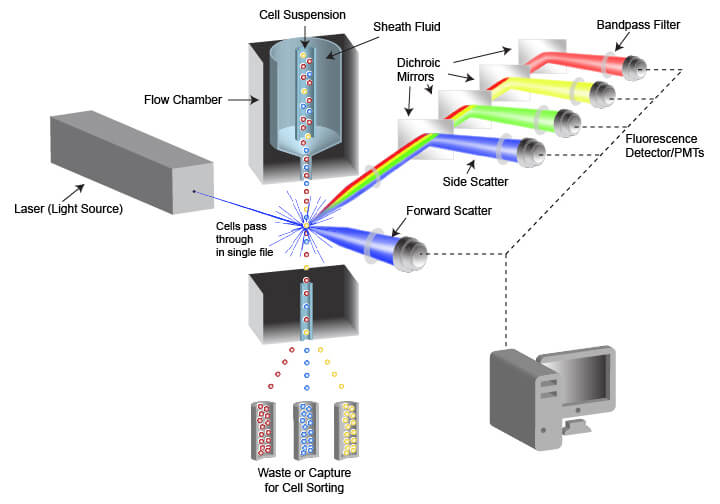
流路系は単一細胞の均一な流れを作り、光源が細胞に照射された時に適切な解析ができるようにします。これは、細胞をサンプルチューブからフローチャンバーに注入するために、加圧ラインを使うことにより実現します。チューブやマルチウェルプレートに調製した細胞サンプルを採取し、フローチャンバー中の層流を形成した液流 (シース液) の中心に注入します。シース液は流体力学的絞り込みと呼ばれるプロセスを介して、幅の狭い細胞の流れを形成するを助け、細胞をほぼ一列に整列させます。超音波を利用した絞り込みで、より一直線に細胞を整列させるサイトメーターもあります。これにより、サイトメーターの光学系を通過する細胞が均等に照らされ、解析できるようになります。
流路系が正しく調節されていない場合や、サンプルの細胞の密度が高すぎる場合は、光学系を複数の細胞が同時に通過して、適切な単一細胞の解析ができなくなります。このような問題が発生するのを防ぐため、多くのフローサイトメーターでは、ユーザーが流速やサンプルのシース液への注入の速度を調節できるようになっています。シース液の流れを一定に保ったまま注入速度を落とすことにより、高密度の細胞懸濁液を用いた場合でも細胞同士の間に間隔を空け、検出器を単一細胞が通過するように調整することができます。
フローサイトメーターの光学系には、照射光源やフィルター、レンズ、集光光学系が含まれます。照射光源には1つないし複数のレーザー光を用い、それぞれが異なる波長のレーザー光を照射します。サイトメーターの流路系を流れる細胞 (または細胞以外の解析対象、蛍光ビーズなど) にレーザーを照射し、レーザーの散乱光と蛍光の放出を検出します。フローサイトメーターは、2種類の散乱光を定量化します。前方散乱光は、レーザー光に平行な光の回折から得られるパラメーターで、通常はレーザー光の前を通り過ぎた物体の大きさを反映します。側方散乱光は、照射角度から90°の方向に散乱したレーザー光で、物体内部の複雑性や光学濃度の違いによって変化するパラメーターです。物体から放出される蛍光は、多くの場合アッセイに用いた蛍光色素によるものですが、解析対象が蛍光ビーズの場合はその自家蛍光を検出します。解析対象が細胞の場合にも自家蛍光が観察されることがあります。散乱光と蛍光の強度や量は、光ダイオード (PD) や光電子増倍管 (PMT) で検出し、検出された光子を数値化して表示、解析します。複数の異なる検出器があり、光散乱と放たれた蛍光の異なる波長を別々に定量化することができます。検出器自身が波長を区別して検出するのではなく、光路に配置した光学フィルターで目的の範囲の波長の光が検出器に届くように調整します。
フローサイトメトリーで特異的な標的を解析するため、細胞構成成分を蛍光標識します。この染色は単体の蛍光分子 (細胞染色色素など)、または蛍光色素で標識した抗体 (直接標識した抗体か、標識した二次抗体を使用する) を用いて行います。
抗体は、様々な生物学的アッセイにとって重要なツールであり、フローサイトメトリーもその例外ではありません。抗体は単一のタンパク質やタンパク質修飾に特異的に結合するので、この性質を利用して標的分子の検出を行います。このようにして標識することで、様々なタイプの細胞、病態、生物学的処理の条件下、発生段階、その他生物学モデルにおける標的タンパク質の量や活性を解析することができます。
異なるタンパク質に結合する抗体は互いに干渉することがないため、複数の抗体を使用して、複数の標的を同時に検出することができます。これはマルチプレックス解析として知られています。個々の抗体を独立に検出できる限り、マルチプレックスの数を増やすことが可能です。フローサイトメトリーでは、異なる分子を異なる蛍光色素で標識することで、マルチプレックス解析が可能になります。良好な実験結果を得るためには、特異性の高い検証済み抗体を安定した蛍光色素と組み合わせて用いることが重要です。
一般に、蛍光色素には照射された光より長波長の蛍光を放出する性質があります。例えば、GFP (Green fluorescent protein) に青色のレーザー光を照射すると、これを吸収して緑色の蛍光を放出します。吸収した光の波長と放出した蛍光の波長の差はストークスシフトと呼ばれます。
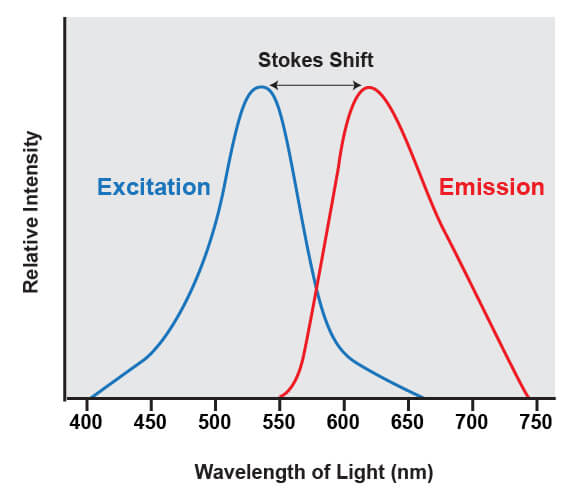
このシフトによって励起源からの光の波長が除去できるようになるため、色素の放出した蛍光を正確に定量できるようになります。励起源は解析対象の色素が放出する蛍光よりはるかに明るいため、その光を除去することができなければ検出器に負荷がかかります。
蛍光色素が吸収する光の範囲を「励起」スペクトル、放出する蛍光の波長を「蛍光」スペクトルと呼びます。実験用途で一般的に用いる蛍光色素の励起スペクトルと蛍光スペクトルはよく調べられており、多くの場合、それぞれの色素が吸収する波長と放出する蛍光の波長が曲線で示されます。
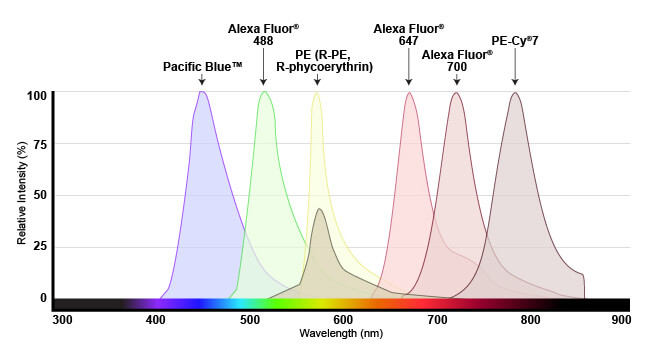
この蛍光スペクトルと励起スペクトルをもとに、利用できる機器で使用できる蛍光色素を調べます。色素が使用可能な条件として、利用するフローサイトメーターがその色素を励起できるレーザーを備えていること (励起スペクトル内にレーザーの波長がある、もしくは励起曲線の最大波長あるいはピーク波長の近傍が望ましい) が挙げられます。同様に、その色素の蛍光波長を選択的に検出できる光学フィルターと検出系を備えていること (同じく蛍光曲線のピーク波長の近傍が望ましい) が必要です。
蛍光色素のサイズは、低分子から大きなタンパク質まで多岐に渡ります。蛍光色素には細胞染色色素として独立して機能するものもあり、これらは細胞の特定の構成成分に結合します。この例としては、DNAに結合すると蛍光を放出する色素ヨウ化プロピジウム (PI) やDAPI、固定前の生細胞と死細胞を区別して標識する生死判別色素などがあります。細胞を予め生死判別色素で染色しておけば、細胞が固定化され、細胞内の標的を抗体で標識した後であっても、死細胞を解析から除外することができます。
GFPなどの蛍光タンパク質は、DNAがコードできるという点で独特です。GFPのDNA配列を特定のタンパク質をコードするDNA配列に追加することにより、蛍光を放出する融合タンパク質を発現する細胞を得ることができます。これにより、in vitroとin vivoの両方のシステムで、タンパク質の位置と量を新たに標識することなく直接解析することができます。GFPのような蛍光タンパク質は、特定のタイプの細胞に、あるいは特定の状態に応答してして選択的に発現させることもできます。特定の細胞が蛍光マーカーで「自己報告」することができると、そのような細胞を選択的に数えたり、分取することもできるようになります。
多くの場合、フローサイトメトリーは蛍光色素を共有結合で結合した抗体を用いて標的分子をラベルします。ここでは、抗体に蛍光色素を結合させることを蛍光標識すると呼び、蛍光標識した抗体を標識抗体と呼びます。標識抗体を細胞アッセイで使用した場合、蛍光色素が放出する蛍光がそのまま細胞内または細胞表面に存在する抗体の量の指標となります。(細胞膜は光透過性があるため、細胞内で蛍光色素分子が発する蛍光はほとんど減衰しません。) 特定のタンパク質またはタンパク質修飾に特異的に結合する標識抗体を使用して、フローサイトメトリーで細胞ごとの蛍光強度を測定することで、細胞内の標的タンパク質を直接定量することができます。この方法は直接検出、または直接フローサイトメトリーと呼ばれます。
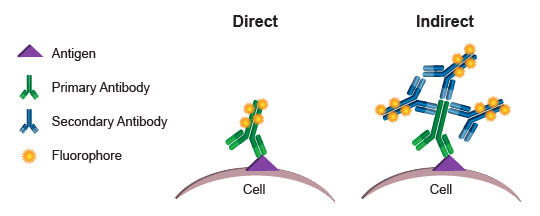
もう1つの方法である間接フローサイトメトリーは、一次抗体の宿主動物の免疫グロブリンに結合する二次抗体を使用します。この方法では、未標識の一次抗体を蛍光標識した二次抗体で検出します。一次抗体を蛍光標識することで立体構造が変化し、抗体の特異性や機能を妨げる可能性がある場合には、直接フローサイトメトリーより間接フローサイトメトリーが好まれます。高いシグナルが必要なときにも間接フローサイトメトリーが好まれます。一次抗体1分子に対して複数の二次抗体が結合するため、間接染色は直接染色より蛍光シグナルが強くなります。間接フローサイトメトリーの欠点は、同時解析で組み合わせることのできる抗体に制限があることです。二次抗体で特異的に検出するために、それぞれの一次抗体をラビット、ヤギ、マウスなど異なる動物種で作成する必要があります。例えば、マウスで作製した一次抗体2つを同じ実験で使用することはできません。これらの抗体を区別して検出することができないからです。
一般的には、二次抗体反応という追加ステップを必要としない、直接フローサイトメトリーが好まれます。しかし、直接フローサイトメトリーでは1度のアッセイで多数の異なる抗体を同時に使用できる点がより重要です。同時に使用できる蛍光色素の種類は、フローサイトメーターが励起できる波長と、区別して定量できる蛍光波長にも大きく依存します。より多くの蛍光色素を組み合わせて使用することで、1度のアッセイで最大限の情報を得ることができます。サンプルが貴重な場合や量に限りのある場合、各抗体をそれぞれ別々に使用せず、同時に複数パラメーターを解析できることは非常に重要となります。
| フローサイトメトリーにおける直接染色と間接染色の比較 | |
|---|---|
| 直接法:直接標識抗体 |
|
| 間接法:未標識一次抗体+標識二次抗体 |
|
他の色素とスペクトルを区別しやすく、かつ蛍光強度の強い色素の開発によって、フローサイトメトリーはより強力な研究ツールとなっています。幅が狭く明瞭なスペクトルをもつ蛍光色素同士は、同時に用いた場合に区別しやすく、このような色素を複数用いることでより多くの分子を同時に検出できるようになります。マルチカラーフローサイトメトリーを成功させるには、組み合わせて用いる蛍光色素の特性と、利用するフローサイトメーターの性能 (フローサイトメーターが備える光学フィルターでそれらの蛍光を区別できるかどうか) を十分考慮する必要があります。実験で組み合わせて用いる蛍光色素の選定 (あるいは組み合わせて用いる抗体の選定も含めて) を、ここではパネルデザインと呼びます。
マルチカラーフローサイトメトリーで複数の蛍光色素を同時に用いる場合、一方の蛍光が他方に漏れ込む可能性があります。この漏れ込みはスペクトルの重複によって起こります。すなわち、一方の色素の蛍光を検出する場合、検出された蛍光の一部は他方の色素に由来する蛍光である可能性があります (下図をご参照ください)。この可能性を考慮しないと、実験結果や生命現象を誤って解釈することになりかねません。このシグナルの重複を補正する過程を「コンペンセーション」と呼びます。コンペンセーションでは、予めそれぞれの蛍光色素が「誤った」検出器に送る蛍光の量を測定しておき、この分の蛍光を多重染色した場合に差し引いて解析します。漏れ込みの量は、個々の蛍光色素を単色で用いたときにそれぞれの検出器で検出される蛍光量を測定するか、1度に1つの蛍光色素を除いて測定する「蛍光マイナスワン」実験を行うことで判断できます。これらの漏れ込み情報に基づいて、実測値に数学的補正を加えてデータの解析を行います。例えば、通常検出器#1で測定する蛍光色素のシグナルの5%が、検出器#2で検出されたとします。その後の解析では、検出器#1が検出したシグナルの5%を計算し、それを検出器#2が検出したシグナルから差し引くことにより、実験結果を補正します。蛍光色素から得られるシグナル強度は細胞ごとに異なるので、コンペンセーションは細胞ごとに行う必要があります。フローサイトメーターによっては、特別な蛍光コントロールを用いてコンペンセーションを行い自動計算されるものや、データ取得後に手動で計算するものもあります。
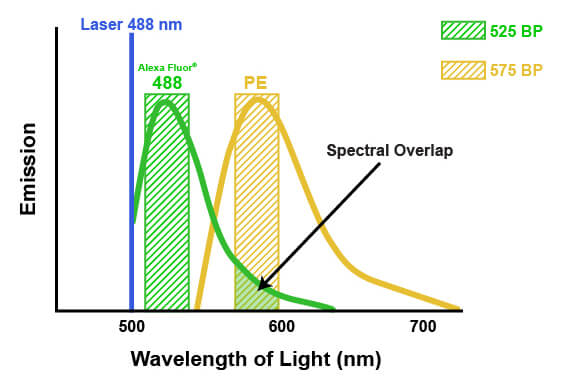
1度の実験で複数の抗体を組み合わせて解析する場合、良好な結果を得るためには適切なパネルデザインが必要になります。標的抗原の量が最も少ない抗体に、蛍光強度の最も強い色素を組み合わせることが推奨されます。これによってバックグラウンドノイズと抗体からのシグナルが区別しやすくなり、正確に定量されやすくなります。また、励起波長の異なる蛍光色素、または、蛍光波長が大きく離れた蛍光色素を選択し、スペクトルの重複を最小限に抑えることも重要です。これによって個々の抗体由来の蛍光を区別して検出しやすくなり、コンペンセーションの必要性を減らす (または不要にする) ことができます。パネル内の抗体数が増えるにつれ、スペクトル分離を維持することがより困難になります。
タンデム色素 (APC-Cy®7やPerCP-Cy®5など) を利用すると、1度の実験で使用できる色の数をさらに増やすことができます。一般的に、タンデム色素は励起波長と発光波長の間の波長のシフトを増大させます。これにより、同じ波長で励起される蛍光色素で標識した抗体の数を増やすことができます。タンデム色素は、蛍光共鳴エネルギー移動 (FRET) と呼ばれる効果を利用しています。1番目の蛍光色素をある波長で励起し、最大エネルギー状態に達すると、エネルギーが2番目の蛍光色素に移動します。これにより2番目の蛍光色素から蛍光が放出され、1番目の色素より波長の長い蛍光が放出されることになります。PEやAPCはタンデム色素によく用いられる蛍光色素で、Cy®5やCy®7など多様なシアニン色素と組み合わせて用いられます。
タンデム色素を使った場合、コンペンセーションはより困難で、不適切に適用するとアーティファクトの原因となります。適切な補正コントロールにより、実験のデータを誤って解釈するリスクを低減することができます。
フローサイトメトリー解析のサンプル調製は重要なステップであり、アッセイ、抗体ごとに最適化する必要があります。一般的に、抗体が標的分子に結合する効率はプロトコールの条件 (固定や透過化の方法など) に大きく影響されます。標的分子の細胞内 (あるいは細胞表面) 局在性がプロトコールの最適化に大きく影響し得るため、エピトープと抗体のアクセシビリティの確認、非特異的な結合する可能性などを考慮する必要があります。
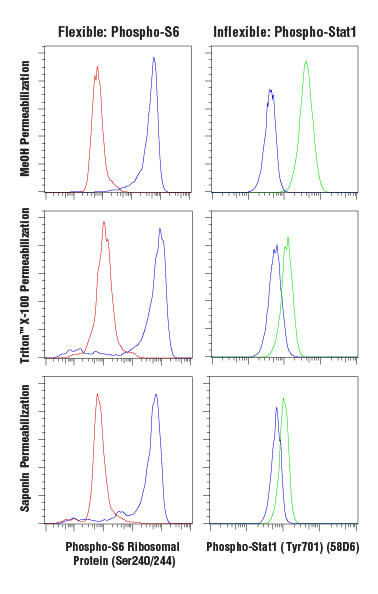
抗体を用いた標的分子の標識には、大きく分けて細胞表面の抗原を染色する方法と細胞内の抗原を染色する方法があります。細胞表面の染色は生細胞で行うことができるのに対し、細胞内の染色には細胞の固定と透過化が必要になります。固定操作を行うことで、固定した時点の細胞状態が保持され、標識過程や細胞の解析過程での変化を防ぎます。固定にはホルムアルデヒドがよく利用され、ホルムアルデヒドは細胞膜を損なうことなくタンパク質をクロスリンクすることで細胞を固定します。透過化は、抗体が細胞膜を通過し細胞内分子と結合することができるようにするために行います。透過化処理に用いる試薬の選択は、アッセイで用いる抗体の特異性と機能に大きな影響を与えます。透過化には、メタノールなどの有機溶媒や、Triton™ X-100やサポニンなどの界面活性剤を用いるのが一般的です。この中でサポニンが最も透過化力が低く、コレステロールに結合して細胞膜に孔を形成しますが、核膜やミトコンドリア膜などの細胞内膜は透過化しません。Triton™ X-100とメタノールは細胞内の膜も十分に透過化しますが、メタノールはより強い透過化力を持ちます。しかし、メタノールはエピトープを破壊することがあり、表面マーカーに対する抗体の一部など、メタノールによる透過化の後は機能しなくなるものもあります。
固定と透過化の条件の影響を受け難い抗体もありますが、厳しく影響を受け、特定の条件でしか機能しない抗体もあります。これは経験的に判断しなければならず、新しいプロトコールで抗体を使用するときは注意深く試験する必要があります。
固定と透過化の後、希釈した一次抗体中でインキュベートすることで細胞を染色します。これを洗浄した後再懸濁することでフローサイトメトリーで解析することができます。多くの場合、固定と透過化を行なった後に細胞表面の染色と細胞内の染色は組み合わせることができますが、細胞表面を染色する抗体が固定や透過化処理をした細胞に使用できるかどうか、個別に確認する必要があります。
どんな実験でも言えるように、取得したデータを適切に解釈するには適切なコントロールが必要不可欠です。コントロールは、生物学的処理の効果、サンプル間の差異、バックグラウンドレベルなどの情報を得るのに必要で、コンペンセーションを行う場合にも必要になります。バックグラウンドや自家蛍光のレベルを確認することで、抗体由来の実際のシグナルを判断することができます。
バックグラウンドシグナルのレベルは、未染色の細胞かアイソタイプコントロール抗体を使うことによって判断できます。アイソタイプコントロールは、抗原結合ドメインが細胞内の分子に結合せず、実験で用いた抗体 (ラビットIgG抗体など) と定常領域 (非結合ドメイン) が一致する抗体です。アイソタイプコントロールは、直接比較できるように実験用抗体と同じ蛍光色素で標識する必要があります。アイソタイプは、タンパク質のそのクラスで発生する結合を予測することができます。例えば、細胞表面分子はラビットIgG抗体の定常領域に結合する可能性があります。
アイソタイプコントロールを用いることで非特異結合のレベルを推定することができますが、実験で用いた抗体の特異性を示すことはできません。抗体の特異性は、既知の陽性条件 (例えば内在性発現、過剰発現、タンパク質の修飾を誘導するための処理など) で得られた蛍光を、既知の陰性条件 (例えばノックアウト、内在性ネガティブ、タンパク質の修飾を抑制するための処理など) で得られた蛍光と比較することにより得られます。抗体の特異性は、実際の実験と同じプロトコールで確認します。
マルチカラー実験の場合、バックグラウンドのレベルを正確に推定するために蛍光マイナスワン (FMO) コントロールが重要です。FMOコントロールは、パネル内の抗体から1つを除いたものです。「空の」チャンネルに残留している蛍光を解析することで、バックグラウンドと陽性シグナルがより正確に区別できるようになります。FMOコントロールは1つのパネル内のすべての抗体に対してとることができますが、パネル内で明確に分離された蛍光色素については省略できることもあります。
コンペンセーションコントロールを用いることで、マルチカラー実験で蛍光の漏れ込み補正を適切に行うことができます。コンペンセーションコントロールには単色の蛍光色素で染色した細胞が用いられ、その蛍光を検出する検出器とその他の検出器で解析して後者に漏れ込む蛍光を判定します。コントロールで測定された蛍光シグナル強度は、実験で観察されるものと同等である必要があります (検出器の感度設定を実際にサンプル解析をする条件に合わせる必要があります)。各検出器に設定したゲイン (電圧) を変化させた場合は、コンペンセーションを再度行う必要があります。
フローサイトメトリーのデータは一般的に2通りの方法、すなわち散布図かヒストグラムで視覚化されます。散布図はドットプロットとも呼ばれ、2種類のパラメーターをX軸とY軸に沿って同時に表示することができます (下図)。これは2種類のパラメーターの相関性を評価するのに便利な視覚化であり、散乱光や細胞集団の蛍光の特性を示すのによく利用されます。
ヒストグラムは、1つのパラメーターをX軸に沿って示す方法です。Y軸は発生頻度あるいはX軸のパラメーターをもつ細胞数を示します (下図)。通常この表示は、細胞集団を通した蛍光の強度を評価するために使われます。
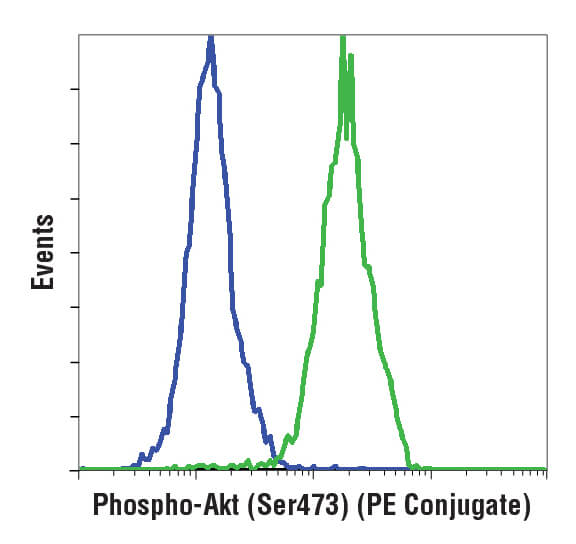
ヒストグラムと散布図の両方の解釈の仕方を知ることは、フローサイトメトリーの解析に必須です。
フローサイトメトリー実験の最も重要なステップの1つはデータ解析です。このステップは、特に大量のデータを得られる実験では非常に複雑化することがあります。フローサイトメトリーには細胞それぞれの多数のデータポイントを得られる利点がありますが、各パラメーターが何を表すかへの意識と理解を維持することが、データの操作や解釈の誤りを避けるために大変重要です。これは細胞を直視することなくフローサイトメーターが提示する数値のみから結果を解釈をする必要があるため、非常に重要になります。これと対照的なのはウェスタンブロットと、免疫蛍光染色した細胞や免疫組織化学染色したパラフィン包埋組織の顕微鏡観察などです。これらのアッセイではデータを視覚的に理解し、サンプルの品質、抗体の特異性、バックグラウンドレベルが比較的直感的に理解しやすい面があります。
フローサイトメトリーで得られる各パラメーターを適切に利用すれば、標的の集団まで階層的に掘り下げて解析を行うことができ、これらの細胞集団に特異的な生物学的知見を得ることができます。これにはフローサイトメトリーによるデータ解析に必要不可欠なツールの1つ、ゲートの設定を利用することができます。
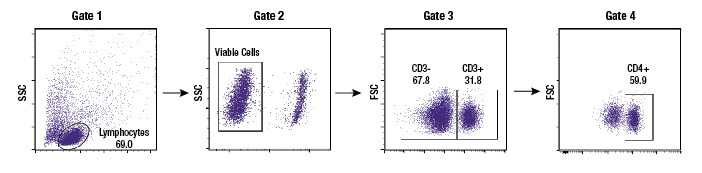
ゲーティングは、解析対象の一部を任意に選択して、その集団を全体の解析対象とは切り離して独立に解析するデータ解析方法です。ゲーティングは、不要なデブリや細胞塊を解析対象から除去したり、不均一な細胞集団の中から細胞のタイプごとに個別に測定基準を設けたりするために、ほとんどすべてのフローサイトメトリー解析で行われます。ほとんどのフローサイトメーターソフトで、解析で得られた散布図やヒストグラムから簡単にゲートの設定を行うことができます。このため、CDマーカーなど、特定の細胞集団を特定するためのパラメーターを選択し、この情報をもとにゲートを設定することで特定の細胞集団を選択的に解析することができます。ほとんどの場合、1つのサンプルでゲートの設定を行い、その条件を保存しておけば、他のサンプルの解析にもそのまま適用することができます。こうすることで、特定の細胞集団を一貫した条件で選択することができます。
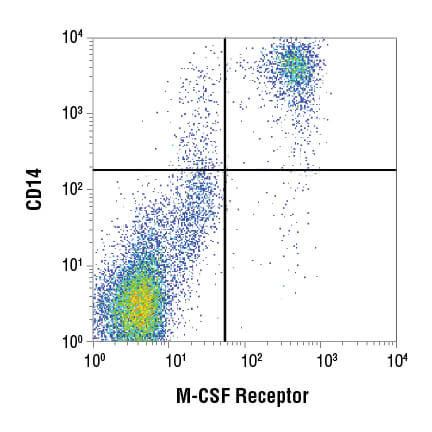
ゲートを設定して選択した細胞集団の一部にさらにゲートを設定することも可能で、階層的なゲート設定 (サブゲーティング) を行うことができます。これを利用して、まず散布図の情報から細胞のダブレットや細胞塊を解析対象から外し、単一細胞のみを解析対象とするようにゲートを設定することもできます (例えば、同一パラメーターのパルス処理を利用し、ピークバルスと積分パルス、あるいはパルスの高さと幅の情報を比較して設定することができます)。続いて、ここで選択した単一細胞の集団で第2の散布図を表示し、この細胞集団からさらにCD3陽性の細胞のみを選択してゲート設定をすることもできます。これら「CD3陽性」細胞はT細胞の集団です。この集団でさらに第3の散布図を表示し、血中を循環する主要な2種のT細胞 (CD4陽性細胞とCD8陽性細胞) を分類することもできます。個々のゲートが定義した集団ごとに、細胞数や蛍光強度の平均値、その他のデータを取得することができます。
フローサイトメーターで特定の細胞集団を選定したら、そこから得られる最も基本的な情報は、定義された集団に存在する細胞の数です。その集団のサイズは、細胞数か、サンプル中の解析対象の全細胞集団に対する割合として表示されます。多くの場合、細胞の割合は、解析で示した複数のゲート内に表示されます。これによって、第三者がそれぞれの細胞集団をどのような線引きで分類したのかを知ることができます。また、複数のゲートを表示し、各ゲート内に細胞の割合を表示させておくことは、ある処理に応答して細胞集団の割合が変化することを示す場合に非常に有効です。
光ダイオードまたは光電子増倍管により得られたデータは、蛍光強度として知られる無次元数で示されます。強度を規定する単位はないため、数値は実験内での相対値として表示されます。蛍光の数値は、相対的な大きさの基準となるものを設定しておかないと、機器間どころか実験間でも比較することができません。
結論を客観的に説明する場合や、細胞集団の特徴を述べる場合は、その細胞集団から算出される平均蛍光強度あるいは蛍光強度の中央値 (MFI:median fluorescence intensity) を報告する場合が多いです。ここで平均とは、特定の実験で解析された全細胞の蛍光強度の平均値を指します。この値は外れ値の影響を大きく受けるので、信頼性の高い評価基準とは考えられていません (外れ値を検討に入れる必要がある場合を除きます)。蛍光強度中央値も報告されますが、これは時折発生する外れ値の大きな影響を受け難いため、比較的安定した評価基準となります。