View in English?
View in English?
細胞内フローサイトメトリーで、アポトーシス、多能性状態、エピジェネティック制御といった固有のシグナル伝達イベントを解析することができます。シグナル伝達のプロファイルを、細胞集団内の中から特定の種類の細胞を選んで、細胞タイプごとに分析することができるため、異なる細胞タイプの間での作用メカニズムの比較ができます。
フローサイトメトリーでは、細胞表面マーカーに基づいて細胞を分類し、サイトカインの放出、転写因子の産生、リン酸化シグナルの活性化といった細胞機能を、細胞タイプと関連づけて解析することができます。以下に、免疫細胞のある特別な集団で起こる、特異的なタンパク質の発現や、翻訳後修飾を解析した例を示します。いくつかの例においては、これらは単純な「印」ではなく、その細胞の機能や活性化を決定づける重要な役割を果たしています。
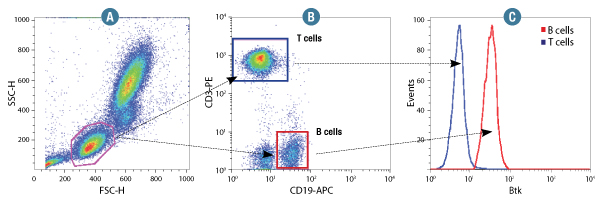
Btk (D3H5) Rabbit mAb #8547: CSTのFlow Alternative Protocolに従い、ヒト全血を固定・透過化処理した後、#8547を用いて免疫染色しました。前方散乱光 (FSC)、側方散乱光 (SSC) のデータからゲートを設定し、リンパ球細胞を選別しました (A)。また、リンパ球の中からT細胞とB細胞の集団をを区別するため、これらの細胞はCD3-PEとCD19-APCで同時に染色してあります (B)。B細胞 (赤) とT細胞 (青) の細胞集団にそれぞれゲートを設定し、Btkの平均蛍光強度をヒストグラムとして示しました (C)。
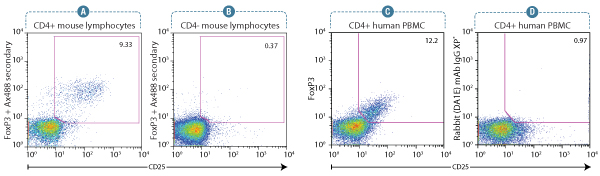
FoxP3 (D608R) XP® Rabbit mAb #12653: CD25抗体および#12653を用いた、マウス脾臓リンパ球のフローサイトメトリー解析。二次抗体として、Anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 488 Conjugate) #4412を使用しました。CD4+リンパ球 (A) とCD4-リンパ球 (B) #12653にゲートを設定し、それぞれの細胞集団でFoxP3、CD25の発現プロファイルを解析しました。FoxP3+/CD25+ Treg細胞で適切な強度のシグナルが得られ、全細胞中に含まれる制御性T細胞の割合が分かります。
FoxP3 (D608C) XP® Rabbit mAb #12632: CD4+でゲートを設定したヒト末梢血単核球の、FoxP3、CD25発現プロファイルを解析しました。CD25+細胞におけるFoxP3の発現を#12632で解析したものを (C) に示し、CD25+細胞でみられるバックグラウンドのレベルを同一濃度のRabbit (DA1E) mAb IgG XP® Isotype Control #3900を用いて (D) に示しました。二次抗体として#4412を使用しました。FoxP3 (D608C) Rabbit mAb #12632により、適切なシグナル強度が得られ、FoxP3+/CD25+となる細胞集団の割合を明確に定義することができます。
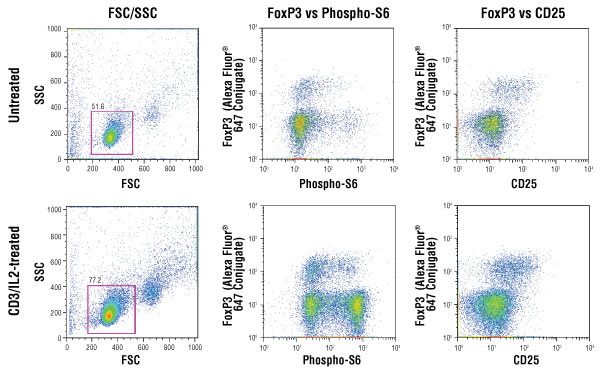
マウス脾臓細胞を単離、CD25を緑色蛍光で染色して、CD4+ T細胞を濃縮し、CD3コーティングしたプレート上でIL-2 (20 ng/mL) 刺激した細胞 (下パネル) と、未処理のコントロール細胞 (上パネル) を調製しました。続いて、細胞を固定・透過化し、FoxP3 (D608R) XP® Rabbit mAb conjugated to Alexa Fluor® 647 #13399とPhospho-S6 Ribosomal Protein (Ser235/236) (D57.2.2E) XP® Rabbit mAb conjugated to PE #5316で染色しました。マウス脾臓細胞モデルシステムは、慶応義塾大学医学部微生物学・免疫学教室 (東京都新宿区) の中川竜介博士からご提供いただきました。
クロマチンの凝集・弛緩によって、それぞれ遺伝子発現の抑制・促進が起こります。DNAやヒストンの修飾は、このようなクロマチン動態を調節しており、エピジェネティクス解析では、これらの修飾を解析します。
細胞の全体的なエピジェネティクス修飾の傾向を、フローサイトメトリーで解析した研究が増えています。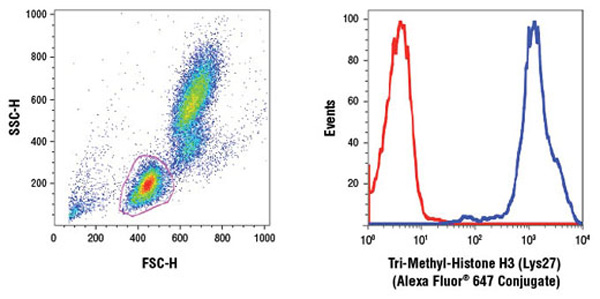
ヒト全血を、CSTのFlow Alternate Protocolに従って固定・透過化し、Tri-Methyl-Histone H3 (Lys27) (C36B11) Rabbit mAb (Alexa Fluor® 647 Conjugate) #12158を用いて染色しました。前方/側方散乱光から、リンパ球にゲートを設定し (左図)、Tri-Methyl-Histone H3 (Lys27)で染色した場合 (青) と、同濃度のRabbit (DA1E) mAb IgG XP® Isotype Control #2985 (Alexa Fluor® 647 Conjugate) で染色した場合 (赤) の平均蛍光強度をヒストグラムに示しました (右図)。
幹細胞は次のような2つのユニークな特性を持っています。(1)「多分化能」を持ち、異なる細胞系統に分化することができます。(2)「自己複製能」を持ち、培養で制限なく増殖することができます。
胚性幹細胞 (ESC) は、体のあらゆるタイプの細胞に分化する能力をもち、「多能性を持つ」といわれています。細胞内フローサイトメトリー解析により、様々な生物学的な刺激に応答して変化する、ESCの多能性状態を把握することができます (下記の例をご参照ください)。
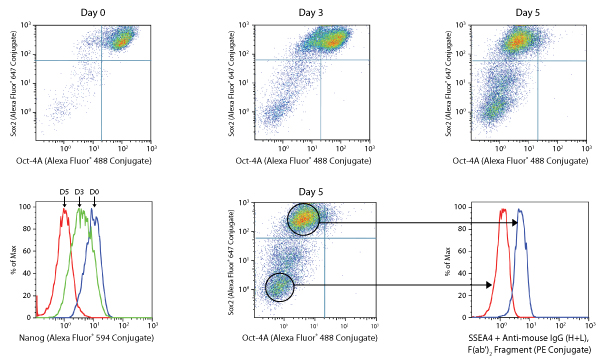
NTERA-2分化アッセイ
胚性がん細胞株NTERA-2は、多能性を持つと言われており、レチノイン酸 (RA) 刺激に応答して神経外胚葉系統に分化します。これらの細胞をRA (5 μM) で5日間に亘って処理すると、Sox2やOct4 (ドットプロット、A)、また、NanogやSSEA4 (ヒストグラム、B) などの多能性マーカーの発現が徐々に低下する様子が観察できます。結果的に、完全に分化の進んだ、ダブルネガティブなニューロン細胞が現れることを確認できます。
アポトーシスは、核凝集、細胞収縮、膜ブレブ形成、DNAの断片化を特徴とする、制御された細胞死のメカニズムです。システインプロテアーゼファミリーであるカスパーゼは、このプロセスの中心的な制御因子です。
アポトーシスの研究においては、アポトーシスマーカーを単独染色、あるいは細胞の生死を判定する色素と同時染色した細胞を、フローサイトメトリーで解析する手法がしばしば用いられています。

Annexin V-FITC Early Apoptosis Detection Kit #6592: 未処理 (左) またはCamptothecin (10 μM、4時間、右) 処理されたJurkat細胞における、#6592のフローサイトメトリー解析。
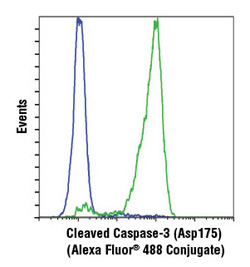
Cleaved Caspase-3 (Asp175) (D3E9) Rabbit mAb (Alexa Fluor® 488 Conjugate) #9603 未処理 (青)、もしくはEtoposide #2200 (緑) で処理されたJurkat細胞における、#9603のフローサイトメトリー解析。