View in English?
View in English?
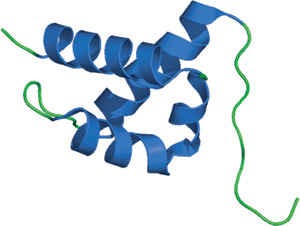
ヒトHYPA/FBP11由来のFFドメイン
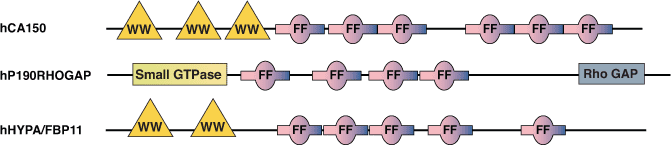
FFドメインは、様々な核内転写因子やスプライシング因子、RhoGAPのp190ファミリーにみられます。このドメインは酵母からヒトまでよく保存されており、植物のタンパク質にもみられます。FFドメインは、N末端とC末端に保存された2つのフェニルアラニン残基で特徴付けられた、約50-60アミノ酸残基から成り、しばしば直列の反復配列として配置されています。ヒトの転写因子CA150およびスプライシング因子hHYPA/FBP11のFFドメインはともに、RNAポリメラーゼIIのCTD (C-terminal Domain) のリン酸化されたセリン残基を認識して結合することが知られています。CA150のFFドメインはまた、低い親和性で (D/E)2/5-F/W/Y-(D/E)2/5 モチーフに結合することもできます。興味深いことに、すべての核内FFドメイン含有タンパク質は、N末端付近にWWドメインも持ちます。WWドメインはmBBP/SF1のような必須スプライシングタンパク質と相互作用できることから、転写とスプライシングのプロセスが共役して起こることを示唆しています。
FFドメインは、3つのαヘリックスで構成されており、2番目と3番目のヘリックスの間にあるループの位置に、310ヘリックスの直交する束が配置されています。タンデム配置の配列に一致して、N末端とC末端はこの構造の両端にあります。2つの高度に保存されたフェニルアラニン残基は1番目と3番目のヘリックスの中央に存在し、このタンパク質の疎水性コアの形成を助けています。このFFドメインの構造は、他のリン酸化セリン/スレオニン結合ドメインとは著しく異なる構造をしており、これらのモジュールに新規の折り畳み構造を示しています。リガンドとの相互作用は、ヘリックス1と4の間の正電荷を帯びた残基のクラスターを通じて媒介されると提唱されています。
| FFドメインに含まれるもの | 結合パートナー |
| ヒト転写因子CA150 | C末端ドメイン (CTD) のセリン残基がリン酸化されたRNAポリメラーゼII、Tat-SF1 |
| 酵母のスプライシング因子Prp40 | C末端ドメイン (CTD) のセリン残基がリン酸化されたRNAポリメラーゼII |
| 酵母スプライシング因子HYPA/FBP11 | C末端ドメイン (CTD) のセリン残基がリン酸化されたRNAポリメラーゼII |