View in English?
View in English?
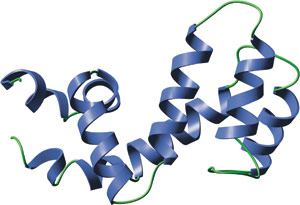
RGS-4のRGSドメイン
RGS (Regulator of G protein Signaling) ドメインは、約120のアミノ酸残基から成り、20種類以上のヒトのタンパク質でみられます。RGSドメインは、ヘテロ三量体のGタンパク質αサブユニットのGTP結合ポケットの遷移中間体を安定化させることで、アロステリックに作用します。これがαサブユニットの内在性GTPase活性を亢進します。RGSドメインの発見によって、Gタンパク質が関与するシグナル伝達プロセスの周期に比して、多くの三量体Gタンパク質でみられる内因性のGTP加水分解速度が遅すぎるという、長年認められてきた食い違いに解答を与えることができました。ヘテロ三量体Gタンパク質は、ホルモン、神経伝達物質、光、匂い物質など、多くの重要なアゴニストによって活性化される、7回膜貫通型受容体からのシグナルを伝達します。RGSドメインをコードするタンパク質は、これらのアゴニストそれぞれの伝達時間を制御することによって、そのようなシグナル伝達現象も調節します。
RGSドメインは、右回りの逆平行の4らせんの束 (α4-7) と、このドメインのN末、C末を含む末端の束 (α1-3、α8-9) を形成する、9つのαヘリックスから構成されています。RGS4とGaiの間の相互作用表面は、α3-4の間のループ、α5-6の間のループ、α7の終点、α8の開始点によって形成されます。すべてのRGSドメインは、アミノ酸同一性の低いメンバーでさえ、非常に類似した三次構造を共有します。興味深いことに、RGSドメインの構造は、p120 RhoGAPのような単量体Gタンパク質のGAPドメインの構造とはまったく異なります。
| RGSドメインタンパク質 | 結合パートナー |
| RGS-4 | GΑi, GΑq |
| p115 RhoGEF | GΑ12, GΑ13 |
| RGS-2 | GΑq |
| GAIP | GΑi, GΑq |