View in English?
View in English?
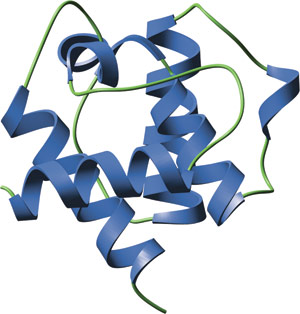
β-spectrinのCHドメイン
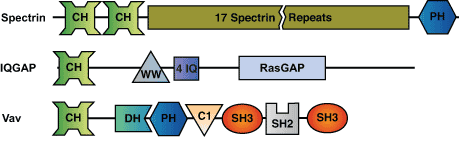
CH (Calponin Homology) ドメインは、約110アミノ酸残基からなるタンパク質モジュールで、細胞骨格やシグナル伝達タンパク質に存みられます。Dystrophinやα-actininなどのSpectrin様タンパク質のN末端において、2つのCHドメインがタンデムにアクチン繊維結合部位を形成します。このようなタンデムのCHドメインは5 - 50 μMの親和性でFアクチンに結合し、アクチン繊維を架橋して網目構造を形成します。CHドメインは少なくとも3つのタイプに分類することができます。タイプ1および 2のCHドメインは、細胞骨格系のタンパク質であるDystrophin、Spectrin、Filaminにおいて、タンデムの形でみられます。タイプ3のCHドメインは、筋収縮を調節するタンパク質 (Calponin) や、シグナル伝達タンパク質 (Vav、ARHGEF6、IQGAP) でみられます。タイプ3のCHドメインはアクチンと直接的な相互作用はなく、むしろタンパク質の活性を調節する制御ドメイン、あるいはタンパク質間相互作用の足場として機能するようです。
CHドメインは、メインとなる4本のαヘリックスで構成され、これらメインのαヘリックスは、長いループ領域や、2-3つの短いヘリックスで繋がっています。3つの主要なヘリックスは平行の束状構造を形成し、N末端のヘリックスがこれに直角に配置されます。タンデムな2つのCHドメインは、最初のドメインのC末端のヘリックスがこの2つのドメインに接続して新たな1つのコンパクトな折りたたみ構造を作るように集まります。
| CHドメインタンパク質 | 結合パートナー |
| β-spectrin | F-actin |
| Fimbrin | F-actin |
| Dystrophin | F-actin |