View in English?
View in English?
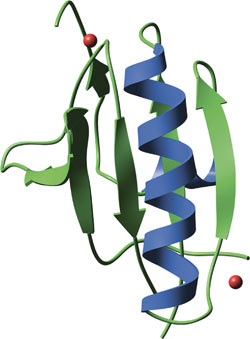
結合カルシウムイオンを赤で示した、ヒトの血漿Gelsolin由来のGELドメイン
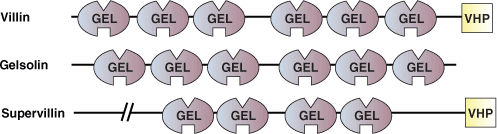
gelsolin/severin/villin相同ドメインとしても知られている、Gelsolin Homologyドメイン (GEL) は、120–150アミノ酸残基からなるドメインで、細胞骨格の調節に関与する多くのタンパク質にみられ、特にアクチン切断タンパク質で重要です。GELドメインはカルシウムとアクチンの両方に結合することから、GELタンパク質のアクチン結合活性はカルシウムによって調節されていることが示唆されています。GELタンパク質は、一般的にアクチン繊維の反矢じり端に結合して単量体の交換を阻害します。すなわち、アクチンフィラメントに対して末端ブロッキングタンパク質またはキャッピングタンパク質として作用します。Gelsolin Homologyドメインを持つタンパク質は、アクチン核形成を促進して新たなフィラメントを作り出し、既存の繊維を切断することができます。
個々のGELドメインは、5ないし6のβ‐シートで構成され、これらのシートは2本の直角に交わるαヘリックスに挟まれています。個々のGELドメインがアクチンを結合できますが、Gelsolinのようなタンパク質は、3つのGELドメインを持ち、それらが協調して、カルシウム制御性のアクチン結合を行います。GELドメインにカルシウムが結合すると、立体構造に再構成が起こり、それがGEL4およびGEL5の連続したβシートのコアを切断してGEL4のアクチン結合部位を露出させます。Gelsolinには3重のGELドメインが2セットあり、それが2つのアクチン分子に結合してアクチンフィラメントの切断とキャッピングを行います。
| GELドメインタンパク質 | 結合パートナー |
| Gelsolin | Ca2+およびアクチン繊維 |