View in English?
View in English?
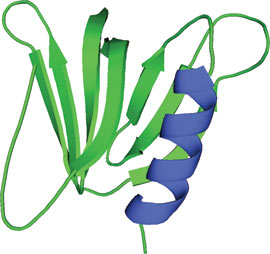
MTMR2のGRAMドメイン
GRAM (Glucosyltransferases, Rab-like GTPase activators and Myotubularins) ドメインは、約70アミノ酸残基から成り、7本鎖βサンドイッチとC末端のαヘリックスを形成します。GRAMドメインはMyotubularinファミリーのホスファターゼに共通して見られ、およそ180種類のタンパク質に存在すると考えられています。MTMR2 (myotubularin related protein 2) のGRAMドメインは、PH (pleckstrin homology) ドメインに見られるような、予想できないほど大きな折り畳み構造を示します。GRAMドメインを持つタンパク質は、大半が膜に関係するプロセスに関与しています。機能解析の研究から、GRAMドメインが、PI-(3、5)P2基質の認識、PI-(3)-P/PI-(5)-P依存型オリゴマー形成、およびMyotubularinホスファターゼのPI-(5)-P特異的アロステリック活性化に関与することが立証されています。GRAMドメインの構造を障害する遺伝子変異は、X連鎖先天性ミオパチーなどのヒト疾患に繋がる可能性があります。
MTMR2のGRAM配列は、構造的にPHドメインの折り畳み構造をとる、より大きなモチーフの一部をなす5本鎖βストランドを形成します。GRAMドメインは、すぐ近傍のアミノ酸残基と共に、C末端にαヘリックスを持つ7本鎖βサンドイッチ構造から成る三次構造を形成します。MTMR2のGRAMドメインの構造は、PleckstrinのPHドメインに非常によく似ています。すなわち、GRAMのコアとなるドメイン中に高度に保存されたアミノ酸残基があり、他のGRAMドメインは、類似したPHドメインの折り畳み構造を共有していると考えられます。
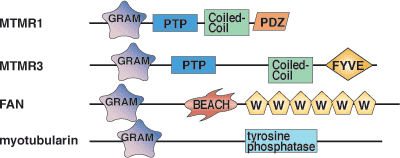
| GRAMドメインタンパク質 | 特異的ホスホイノシチドリガンド |
| MTMR2 | PI-(3,5)-P2, PI-(5)-P |
| MTM1, MTMR3, and MTMR6 | PI-(5)-P |