View in English?
View in English?
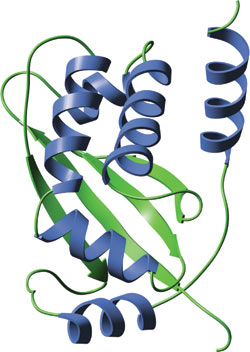
ヒトTRAF2の単量体TRAFドメイン
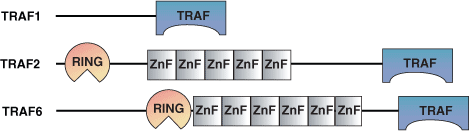
約150アミノ酸残基からなるTRAFドメインはTNF (Tumor Necrosis Factor) 受容体関連因子にみられます。線虫にはTRAFタンパク質は1つしかなく、ショウジョウバエでは2つのみ、そして哺乳類では6つのTRAFタンパク質が存在しているため、TRAFタンパク質の進化的な発展は比較的最近になってからのものと思われています。哺乳類のTRAFは、核でみられるTRAF4を除くとすべて細胞質に局在します。TRAFタンパク質は、TRAFドメインを介して活性化したTNF受容体やIL-1/Toll受容体との相互作用、あるいはTRADDなどの介在タンパク質を介して、膜にリクルートされます。TRAFは、TNF受容体と相互作用し、NF-κBやAP-1転写因子を活性化することで、主に細胞生存に作用します。6つの哺乳類TRAFタンパク質は異なる機能を持ちます。例えば、TRAF3はT細胞依存的な抗原応答を制御し、TRAF4は気管形成に必要で、TRAF6はIL-1、CD40、LPSのシグナル伝達を調節します。TRAFはまた、エプスタイン・バールウイルス (Epstein-Barr Virus) の複製において、LAMP1に結合し、細胞の増殖と形質転換を促進します。
TRAFドメインは非常によく保存されたコイルド-コイル-ドメインから構成されており、それにTRAF-C ドメインが続きます。N末端のコイルド-コイル-ドメインは1本のαヘリックスからなりますが、TRAF-Cドメインはβサンドイッチ構造に折り畳まれています。TRAFドメインはホモ二量体、ホモ三量体、あるいはまたヘテロ三量体などのオリゴマーを形成します。TRAF-2のTRAFドメインの三量体構造は1本の葉柄様構造を形成するコイルド-コイル領域であり、TRAF-Cドメインが3つの分葉を形成しながらこの葉柄の下に付いた構造をとります。
| TRAFドメインタンパク質 | 結合パートナー |
| TRAF 1,2,3,5 | CD40 |
| TRAF 1,2 | TRADD |
| TRAF6 | IRAK |
| TRAF 2 | TNFR1 |
| TRAF 6 | IL-1 |