View in English?
View in English?
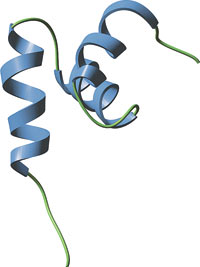
HHR23Aの内部UBAドメイン
UBA (Ubiquitin-Associated) ドメインは、約40アミノ酸残基からなるモチーフで、元々ユビキチン化に関与するタンパク質で認められ、後にDNAのヌクレオチド除去修復に関与するタンパク質にもみられることが確認されました。UBAドメインは、in vitroで単量体および短い (2-4) ユビキチン重合体と結合しますが、長鎖ポリユビキチンとより高い親和性で結合することから、in vivoではポリユビキチン化されたタンパク質がUBAドメインタンパク質の結合する基質であると考えられています。数多くのUBAドメインがホモ二量体を形成し、他の基質とヘテロ二量体化します。機能的には、UBAドメインを持つタンパク質はユビキチン鎖の伸長を制限し、ユビキチン化されたタンパク質を26Sプロテアソームの標的にして分解させると考えられています。
NMRデータによって、酵母のRad23A のヒトホモログ (HHR23A) のUBAドメインは、このタンパク質を安定化させる疎水性コアと3つのヘリックス束を形成することが明らかになりました。これらのドメインはまた、ユビキチンおよび他の標的タンパク質の疎水性領域と相互作用すると考えられる、疎水性アミノ酸残基でできた保存された表面パッチを持っています。
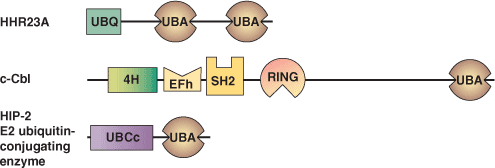
| UBAドメインタンパク質 | 結合パートナー |
| HHR23A | モノユビキチンとポリユビキチン Rad23 (ホモ二量体化) HHR23A (ヘテロ二量体化) HIV Vpr |
| c-Cbl | 未知 |
| HIP-2 E2ユビキチン結合酵素 | 未知 |