View in English?
View in English?
免疫組織化学染色 (IHC) は、構造が保持されている組織サンプルでタンパク質の発現を解析する、抗体ベースの技法です。IHCの技法を用いた研究成果は、1942年にCoons博士らによって初めて報告されました。これは、蛍光標識した抗体で肺炎球菌を視覚化する技法の開発に関するものでした。現在IHCは、生体サンプル中の標的抗原を可視化するために、医療研究、臨床現場の両方で広く利用されています。この技法は、抗体がエピトープを特異的に認識することに依存しています。一般に、このような抗体を利用した手法で正確な解析結果を得るためには、実験条件の最適化が必要になります。組織サンプルを処理する行程には抗原-抗体反応に影響する要因がいくつかあり、標的タンパク質に抗体が適切に結合するためには、このような要因ついて慎重に調整を行うことが必要です。
IHCプロトコールビデオ (パラフィン包埋組織切片)
IHCは抗体と抗原の関係を利用して、生体切片上で生体内原位置 (in situ) のタンパク質発現を視覚化する手法です。この手法には、組織サンプルの解剖学的、構造的情報を保持したまま解析できるという特長があります。このため、構造の維持されたサンプルでタンパク質を高い分解能で可視化し、これが細胞内のどの区画に局在するかを解析することができます。つまり、IHCは免疫学的検出手法と顕微鏡解析を組み合わせた、効率よく簡便な、けれども応用範囲の非常に広い解析手法です。
臨床の場において、IHCは病理学的診断と解析に利用されています。これによって組織サンプルを解析し、腫瘍の形成や転移、感染や炎症反応の病理診断を行います。また、薬剤開発など生物医学的研究の場においても、IHCは解析対象のタンパク質を検出するために、様々な形で利用されています。
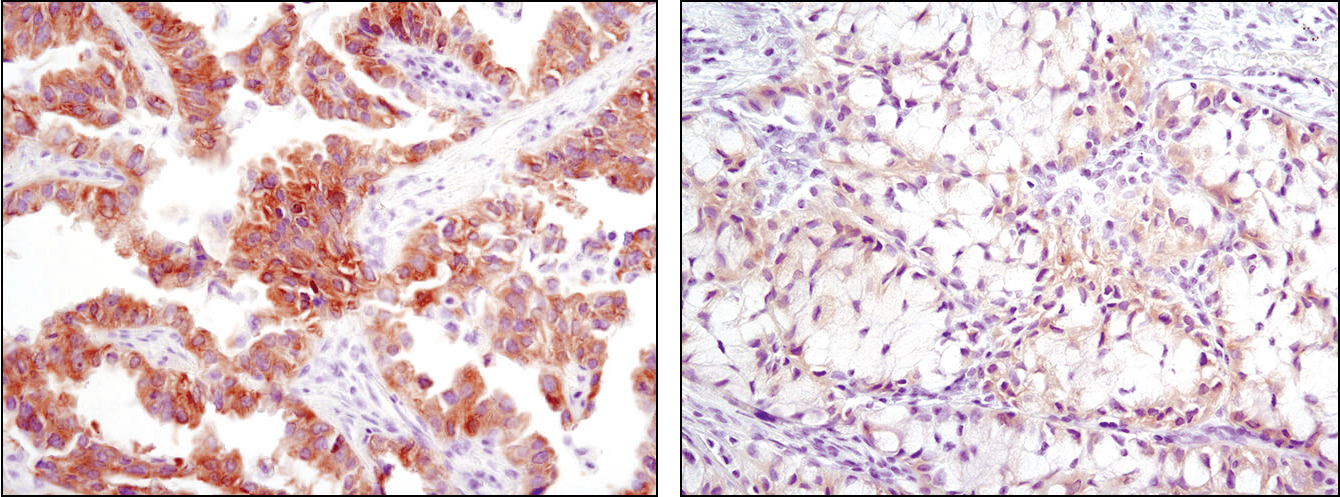
パラフィン包埋ヒト肺がん組織を、ALK (D5F3®) XP® Rabbit mAb #3633を用いてIHCで解析しました。ALKを高発現するサンプル (左) と、低発現するサンプル (右) を示しています。
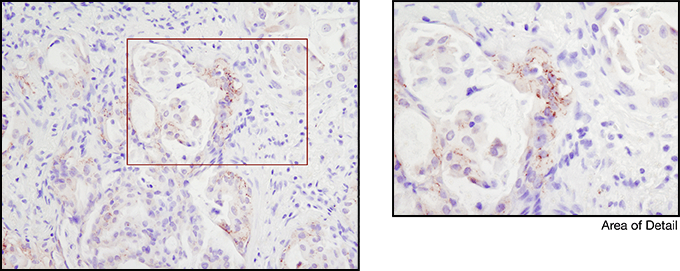
パラフィン包埋ヒト肺がん組織を、ROS1 (D4D6) Rabbit mAb #3287を用いてIHCで解析しました。注意:本実験では、FIG融合型ROS (FIG-ROS1) タンパク質を検出しています (Rimkunas, V.M. et al. (2012) Clin Cancer Res 18, 4449-4457)。
上述したように、IHCの基本原理は抗体で解析対象のタンパク質を特異的に検出することです。しかしながら、実際にはそれほど単純ではなく、より複雑な要因が絡んできます。一般的なIHCの実験の重要なプロセスの概要を述べ、続いて各プロセスを詳細に解説します。
ここでは、CSTが推奨するプロトコールの概要を提示し、どのステップが実験の成功の鍵となるかを説明します。その中で、抗体の検証やテクニカルサポートで積み上げてきたIHCの豊富な経験を踏まえ、CSTが推奨する試薬や手順を解説していきます。IHCは難しい手法で、しばしば問題が生じます。ここでは、お客様が条件検討に費やす時間を最小限に抑え、期待通りに結果が得られるよう、IHC実験のプロセスや原理を解説します。
注意: 本ページの手順は、パラフィン包埋サンプルのプロトコールに対応しています。
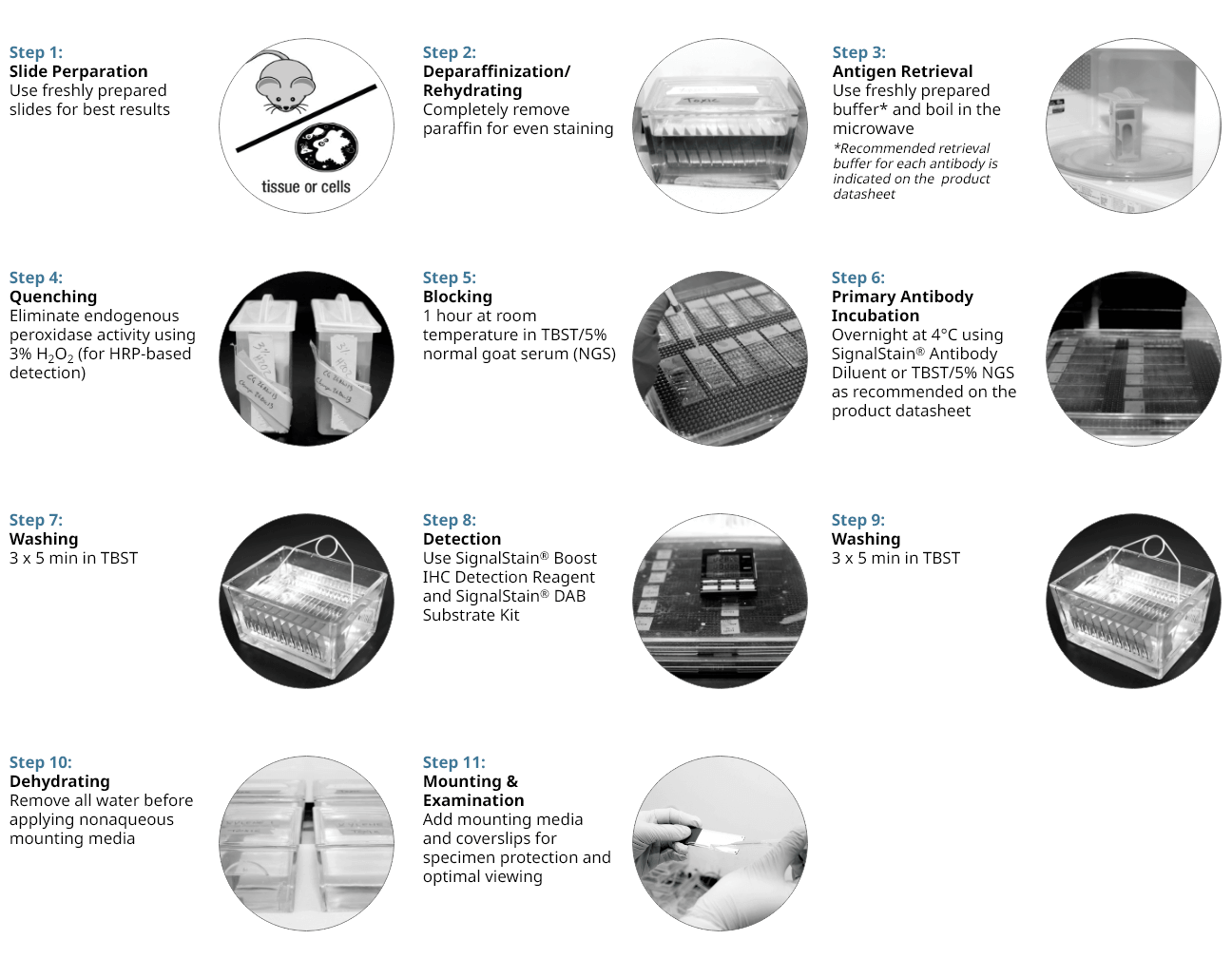
一般的なIHCプロトコール (11ステップ)
組織やそれを構成する細胞の構造を保持したまま解析をするため、これらを固定する操作が重要になります。多くの方法の中から適切な固定法を選択する必要があり、重要性が見落とされがちですが、固定操作は実験の成否に大きく関わるステップです。色々な化学物質を用いて、細胞や組織のタンパク質を強固な構造体として固定します。こうすると生きた細胞の構造を維持したままの骨格が出来上がります。化学的な固定法が一般的ですが、他にも選択肢はあります。固定法は以降のIHCステップをどのように行うかという点も考慮して、注意深く検討する必要があります。
染色のためにサンプルを切片化する必要があるため、固定操作の後、薄切できるように組織をブロック状態に安定化させます。選択した固定法によって組織ブロックのタイプ、包埋剤は異なり、パラフィンベースのもの (ミクロトームで薄切)、温度感受性のある水溶性のもの (クリオスタットで薄切)、寒天 (ビブラトームで薄切) などを使用します。
組織が薄切できるように安定化したら、実験目的に応じた厚さの切片を適切な装置で作成します。違いは数多くあるものの、これら切片作製用機器には共通点が一点あります:それはとても鋭い刃で、損傷をまったく残さないように組織を切片化するということです。刃の種類は使用する機器と、切片化する組織に合わせて選ぶ必要があります。また、刃はこまめに洗浄して鋭さを維持する必要があります。組織切片ができたらスライドに張り付けて風乾した後、次のステップに進みます。
固定操作の過程でマスキングされたエピトープを露出させる (抗原を賦活化する) 必要があり、このためにいくつかの方法があります。プロテイナーゼKのようなタンパク質分解酵素を用いた方法、熱処理でクロスリンクした化学結合を切断してタンパク質を解く方法 (HIER:heat-induced epitope retrieval) などです。どちらの方法もエピトープを露出させることで一次抗体のアクセスを助け、IHCによる染色が可能になります。
CSTで最もよく使う抗原賦活法はHIERですので、この手法について詳述します。HIERでは組織切片をバッファーに浸したまま加熱し、その後冷却します。バッファーのpHは、冷却後もタンパク質の解かれた構造を保つため、解析対象のエピトープ-抗体の相互作用に最適化する必要があります。やや酸性のバッファー、クエン酸 (pH 6.0) は幅広いエピトープの賦活化に効果的ですが、EDTA (pH 8.0) のようなより塩基性のバッファーを要するエピトープもあります。
免疫染色の原理はウェスタンブロットによく似ていますが、タンパク質抽出物を調製して転写膜に固定する代わりに、細胞内の自然な状態を維持したまま固定する (すなわちin situで解析する) 点が大きな相違点です。免疫染色の過程は次の4つの主な部分に分類されます。1) ブロッキングと透過化 (必要な場合)、 2) 一次抗体反応、3) 二次抗体反応、 4) 検出。この4つのステップで、抗体が高い特異性で標的タンパク質に結合し、これを可視化するための最適条件を設定します。したがって、試薬の調製と利用に当たってはいくつかの重要な検討事項 (下記) を考慮し、また、シグナルを最大化し不必要なバックグラウンドノイズを最小限に留めるため、実験条件の微調整を行う必要があります。また、IHCの検出方法には大きく分けて、1) 発色基質を利用したものと、2) 蛍光色素を利用したものの2種類があり、前記の固定法、組織サンプル調製法と同様に免疫染色のプロセスに大きく影響します。最後に、一次抗体を直接標識して標的の検出に用いる直接法と、標的に結合した一次抗体を二次抗体で検出する間接法があり、抗原タンパク質の発現量や抗体のアクセシビリティによってこれを選択する必要があります。
免疫染色操作の後、様々な細胞のコンパートメントや高分子を重ねて染色することができます。これは対比染色として知られています。対比染色は細胞内小器官や細胞の構造成分を標識することができ、標的タンパク質の局在等を検討する上で有用です。
組織の染色がすべて終了したら、顕微鏡観察の準備はほとんど完了です。最後に、染色した組織切片を封入剤とカバーガラスで封入し、顕微鏡スライドを作成します。封入剤には水溶性封入剤と永久封入剤があり、染色の保持や、サンプルに顕微鏡に合わせた屈折率を与えるなどの効果があります。適切な封入剤で退色を防ぎ、染色を保持することで、サンプルを一時保存し、後日写真撮影を行うことも可能になります。
良好な染色像を得るため、サンプルの調製法は大変重要になります。組織の採取と固定はサンプルの完全性と組織内の高分子のアクセシビリティに直接影響を与え、さらに標的タンパク質の抗原性にも影響を与えます。しやがって、実験目的に応じて適切な組織の採取法、固定に用いる試薬、切片化の方法を選択する必要があります。
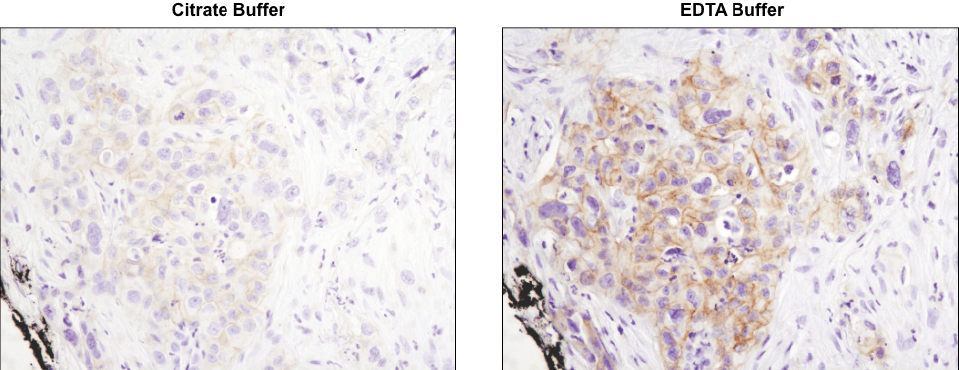
CSTが推奨する賦活化液を使用して、最終的な染色結果の質を高めることができます。 パラフィン包埋ヒト肺がん組織のIHCで、クエン酸バッファー (左) とEDTAバッファー (右) におる抗原賦活化を比較しました。抗原賦活化後、Phospho-HER3/ErbB3 (Tyr1289) (D1B5) Rabbit mAb #2842を用いてIHCで解析しました。この抗体 (#2842) の場合は、EDTAバッファーで賦活化した場合に細胞膜の染色が強くなり、より明瞭な染色像が得られることが分かります。それぞれの抗体に最適な賦活化条件は、製品のデータシートでご確認ください。
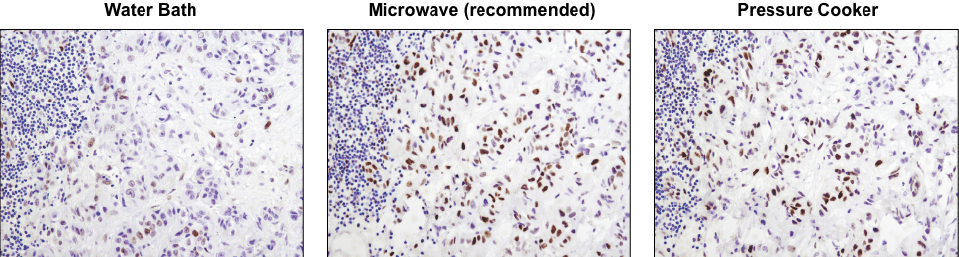
抗原賦活化には電子レンジの使用を推奨します。 パラフィン包埋ヒト肺がん組織サンプルを、ウォーターバス (左)、電子レンジ (中央)、圧力釜 (右) を使用して賦活化した後、Phospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145を用いてIHCで解析しました。電子レンジを使用した場合とウォーターバスを使用した場合で、結果に明確な差が認められます。なお、抗体の種類によっては、電子レンジよりも圧力釜を使用した方が染色強度が高くなる場合があります。
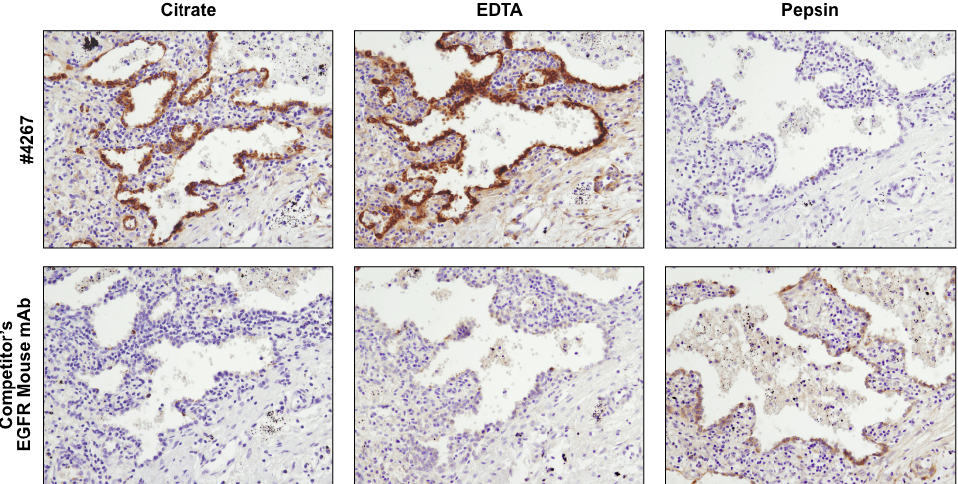
同一タンパク質を標的にする抗体でも、適する抗原賦活化方法が異なる場合があります。 クエン酸バッファーで煮沸 (左)、EDTAバッファーで煮沸 (中央)、またはペプシンで消化 (右) して抗原を賦活化したパラフィン包埋ヒト肺がん組織を、CSTのEGF Receptor (D38B1) XP® Rabbit mAb #4267または他社のEGFR mouse mAbを用いてIHCで解析しました。#4267ではEDTAで賦活化した場合により良好なシグナルが得らますが、他社のEGFR mouse mAbではペプシンで消化した場合にのみシグナルを検出しています。
組織学的サンプル調製では、クロスリンク固定剤が最もよく使用されます。これはアルデヒドベースのものが多く、ホルムアルデヒド、パラホルムアルデヒド、グルタルアルデヒドなどがよく利用されます。アルデヒドによる固定化が抗原の検出または実験目的、観察法に適していない場合は、酸化剤やアルコールベースの固定剤などを利用することもあります。例えば、電子顕微鏡による観察を予定している場合、一般に、より解像度の低い顕微鏡で観察する組織サンプルに比べて強固に固定する必要があります。さらに、アプリケーションによっては、熱処理や凍結乾燥などの物理的固定がより適している場合もあります。
ホルムアルデヒド/ホルマリン固定し、パラフィン (蝋をベースにした包埋剤) で包埋した組織サンプルがよく利用されており、このタイプのサンプルはFFPE (formalin-fixed paraffin-embedded) 組織と呼ばれます。FFPE組織はミクロトームで薄切切片にし、最終的にスライドに封入します。FFPEはサンプルの長期保存に適しており、細胞表面の維持に優れるため、最も一般的に用いられる調製法ですが、切片化した後、免疫染色操作に移る前に抗原タンパク質を露出させて抗体のアクセシビリティを上げる手順が必要になります。そうした手順には、風乾、またはオーブン、電子レンジによる乾燥、有機溶媒による脱パラフィン、抗原賦活化などが含まれ、これらをすべて免疫染色操作の前に行います。特に抗原賦活化は抗原を露出させるために必要不可欠で、pH値の異なるいくつかのバッファーでサンプルを煮沸する方法や、タンパク質分解酵素で組織を消化する方法があります。
組織または抗原がホルマリン固定に適していない場合は、サンプルをパラホルムアルデヒド (PFA) で固定するか、温度感受性のある超低温保存に適した材質で包埋し、液体窒素で瞬間凍結します。どちらの場合も凍結組織は冷却したミクロトームまたはクリオスタットで薄切にし、スライドに封入します。この方法はFFPEよりずっと簡単に組織切片を調製できますが、形態の保存性はあまりよくありません。凍結切片を調製する場合も、凍結による組織の損傷を低減するため、凍結の前に浸透操作で水分子を除去する必要があることにご注意ください。固定していない組織は、切片をスライドに置いた後固定後のステップを行います。クリオスタットで作成した切片をスライド上に置いたら、短時間乾燥させることが必要な場合もあります。凍結切片組織の場合も目的の抗原のアクセシビリティによっては、FFPE組織と同様に抗原賦活のステップが必要です。
別法として、固定した組織自体を包埋することなく、刃を細かく振動させたミクロトーム (ビブラトーム) で直接薄切することもできます。組織は寒天に可逆的に包み込み、ビブラトームで切るのにちょうど良く安定させます。この切片は生理食塩水中で保存し、ウェルで染色することができます。このような切片は厚さがかなりあることが多く、抗体が十分に浸透しない場合があります。しかし組織の完全性は良く保持され、試薬の使用量は最小限に留めることができます。切片は免疫染色操作の後封入します。この場合、組織切片の染色は必要ありません。
免疫染色は、細胞または組織サンプル内の特異的なタンパク質を検出するのに抗体を使用する方法すべてを指す総称です。免疫染色実験を計画するにあたり、採用するプロトコールによっていくつか検討すべき点もあります。次のリソースは、FFPE組織で最適なIHC実験をデザインし実行する際に役立てていただくことができます。
免疫組織化学染色のヒントとテクニック
免疫組織化学染色 (IHC) の改善 概要・ステップ1:抗原賦活化
より良いIHC ステップ2:抗体の希釈
より良いIHC ステップ3:検出試薬
より良いIHC ステップ4:発色基質
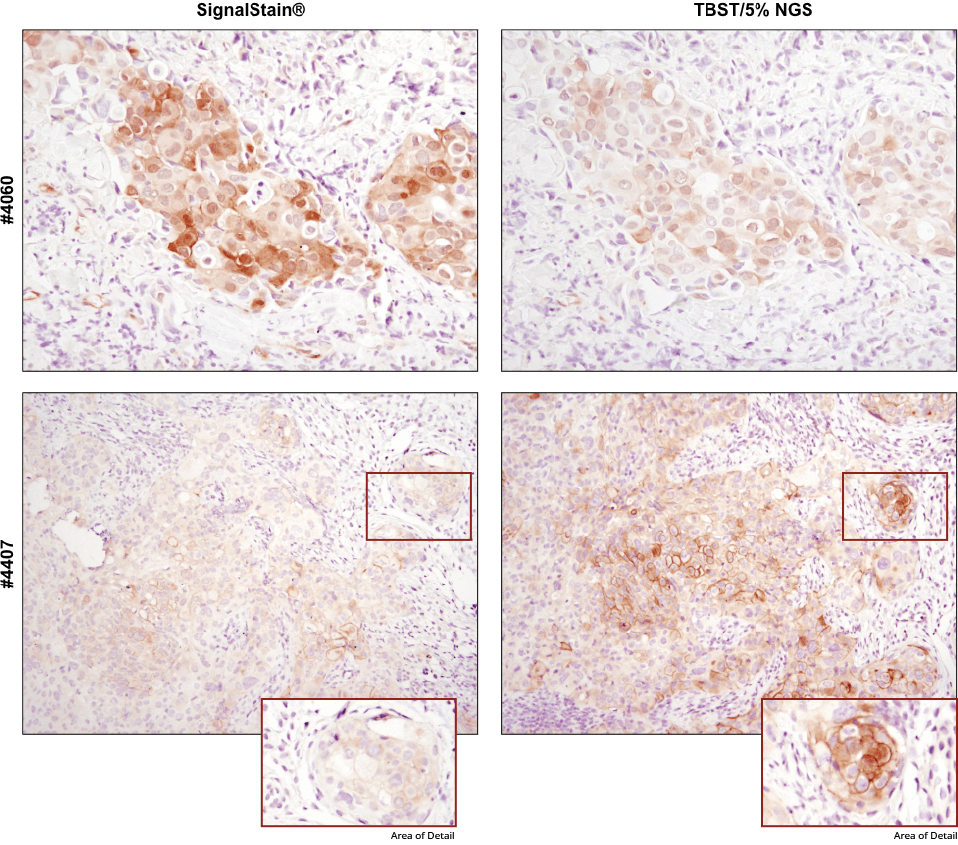
抗体の希釈には、製品のデータシートに記載されているCST推奨の一次抗体希釈液を必ず使用してください。 抗体の希釈にSignalStain® Antibody Diluentを用いた結果 (左) と、5%正常ヤギ血清含有TBSTを用いた結果 (右) を比較しました。上図はパラフィン包埋ヒト乳がん組織をPhospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060で染色した結果、下図はHCC827異種移植片をPhospho-EGF Receptor (Tyr1173) (53A5) Rabbit mAb #4407で染色した結果です。#4060では、5%正常ヤギ血清含有TBSTで希釈した結果に比べて、SignalStain® Antibody Diluentで希釈した場合に良好なシグナルが得られます。対照的に、#4407では、5%正常ヤギ血清含有TBSTで希釈した場合に良好な結果が得られます。それぞれの抗体の推奨希釈液は、製品のデータシートでご確認ください。
すべての抗体が免疫組織化学染色に適しているわけではありません。ある抗体がウェスタンブロットで感度良く特異的なバンドを示したからと言って、同じ抗体がIHCベースのアッセイでも特異的であるとは限らず、全く機能しないこともあります。これは抗原提示における違いのためです。まず、抗体の供給元がどのようにIHCの検証を行っているかを調べてください。理想的にはRimmらにより記述されたように、高発現、中発現、低発現する細胞株や組織で試験したデータを開示すべきです。さらに、細胞ペレットから組織のマイクロアレイまで、複数の実験モデルを使用して抗体の性能を検証し、様々なサンプルで特異性や機能を確認すべきです。また、IHCによる抗体の性能は、透過化、抗原賦活化、検出過程で使用する試薬やプロトコールに大きく左右されます。これらは抗体の供給元が明確に文書化する必要があります。その抗体をIHCで使用した文献を参考にするのも有効です。この際、論文の質や、抗体の希釈や使用法の明確な記述の有無が重要で、引用数はそれほど重要ではないことが多くあります。使用法の参考になる文献が見つからない場合は、供給元がその抗体の性能を検証した方法をまず再現し、それからご自身の目的に合わせて調節すると良いでしょう。実験を開始する前に、その抗体がIHCで検証されていることを忘れずに確認してください。
IHCで検証された抗体をいくつか絞り込んだら、次に検討すべき点がいくつかあります。そのうちの1つに、抗体を産生する宿主の動物種があります。一次抗体の宿主によって、用いる二次抗体が変わってきます。これは、二次抗体が一次抗体と同一宿主のイムノグロブリンを認識する必要があるからです。一次抗体の宿主と組織サンプルの動物種が一致する場合、二次抗体が切片内に残存する内在性IgGに結合することを意味します。したがって、宿主の動物種がサンプルの動物種と一致する一次抗体は避けるのが望ましいと言えます。
一次抗体は標的タンパク質内にあるアミノ酸の特定の配列 (エピトープ) を認識するため、抗原の動物種 (すなわちヒトかマウスか) によって反応性が異なることがあります。すなわち、正確にエピトープに一致したアミノ酸配列を持つ抗原タンパク質に対して最良の結果が得られます。例えば、組織サンプルがヒト由来であれば、ヒト抗原への反応性が確認された一次抗体を使用すべきです。エピトープは異なる動物種間でよく保存されている場合もあり、全く異なる場合もあります。交差性を考慮して賢い抗体の選択をしてください。
ここまでで一次抗体と二次抗体の組み合わせを最終的に決定する準備がほとんどできました。一次抗体の特異的なアイソタイプは、モノクロナールであれポリクロナールであれ、それが産生された種によって異なることを忘れないでください。二次抗体はこのアイソタイプと合致している必要があります。すなわち、一次抗体のIgGアイソタイプを認識する抗IgG H&L (重鎖と軽鎖) 二次抗体を使用する必要があります。これを利用して、同じ動物種を宿主に作成した抗体どうしでも交差反応なく染め分けられることがあります。これについては、下の「マルチプレックス」セクションで詳説します。
一次抗体反応の前に、サンプルのブロッキングを行う必要があります。このステップは、組織内の標的以外のタンパク質に抗体が非特異的結合することを避けるためのものです。
ブロッキングには、様々なタンパク質が希釈された溶液が必要です。これは、サンプルを過剰量のタンパク質でコーティングし、特異的な抗原に未反応の一次抗体や二次抗体が組織切片に非特異的に結合するのを防ぐために行います。ブロッキングは比較的簡単なステップですが、目的によって最適なタンパク質が異なる場合があることにご注意ください。また、ブロッキングに用いるタンパク質が誤って標的エピトープに結合し、検出を妨げることがあってはいけません。ウシ血清アルブミン (BSA) や、様々な動物の血清がブロッキングによく使用されます。血清をブロッキング試薬として使うときは、必ずその由来動物を二次抗体の宿主種と一致させるようにしてください。これにより、二次抗体が組織内のタンパク質に非特異結合する可能性を最小限に抑えます。
必要だからです!実際に、ブロッキングは、一次抗体と二次抗体のサンプルへの非特異的結合を低下させます。免疫染色を成功させるには、特異的な結合が大変重要ですので、このステップを正しく行うことで、最適な実験結果に近づけることができます。
標的タンパク質の免疫標識が完了したら、シグナルの可視化が可能となります。免疫標識タンパク質を視覚化するための検出方法はいくつかあり、免疫染色のステップで使用した抗体の種類よって選択肢が変わってきます。この方法は大きく分けて、1) 発色検出と、2) 蛍光検出の2種類に分類されます。予め検出方法を決めることで、適切な一次抗体と二次抗体 (こちらが特に重要) を選択します。
発色検出には、1) 感度が高い (シグナルを大幅に増幅することができる)、2) シグナルが長く保たれる (保存性に優れる)、などいくつかの利点があります。一方、蛍光ベースの検出方法にも、次のような利点があります。1) 蛍光スペクトルの異なる多種の蛍光色素を利用できるため、多重染色 (マルチプレックス) がより簡単でより高次元なマルチプレックス解析が可能である。2) ダイナミックレンジがより広い。3) タンパク質の共局在を視覚化しやすい。4) 化学基質を必要としないためプロトコールがより簡便で時間効率が良い。IHC法には、一次抗体を直接標識する直接法と、一次抗体に標識二次抗体を結合させる間接法があります。
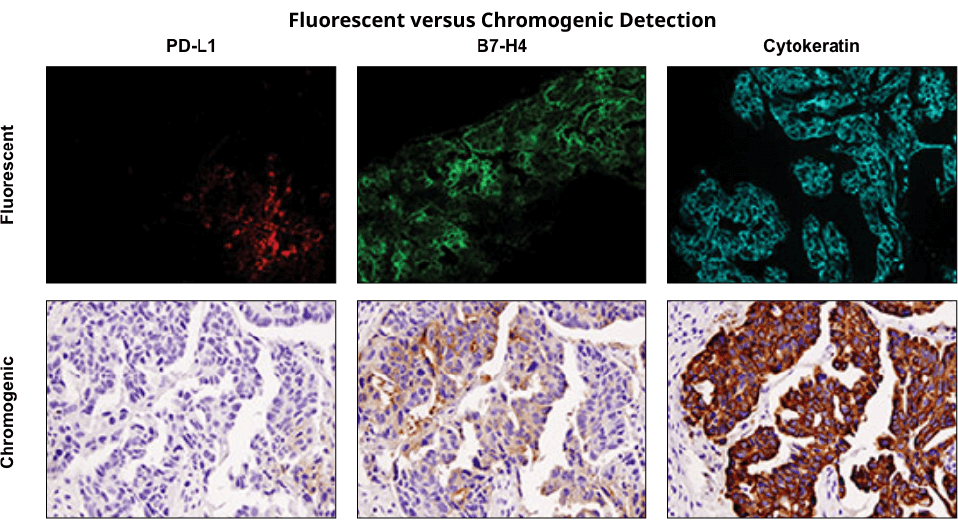
卵巣がんの連続切片を、PD-L1 (E1L3N®) XP® Rabbit mAb #13684 (左)、B7-H4 (D1M8I) XP® Rabbit mAb #14572 (中央)、Pan Keratin (C11) Mouse mAb #4545 (右) で免疫組織化学染色し、蛍光検出および発色検出システムの比較を行いました。注意:異なる撮像視野の画像を取得しました。
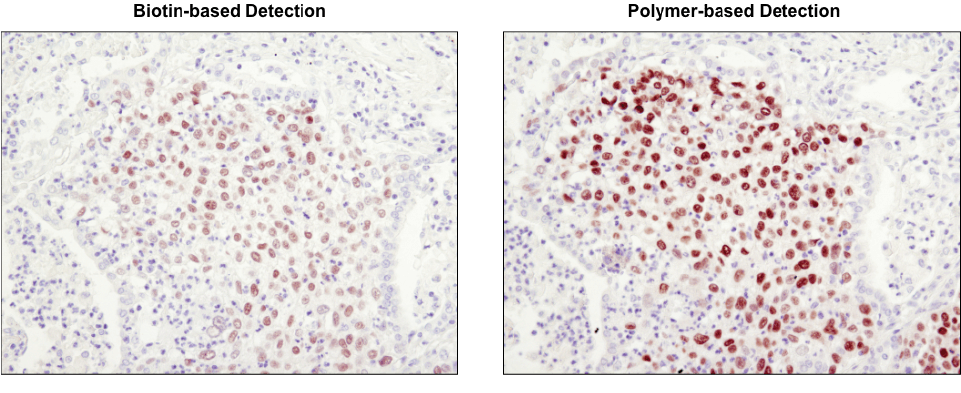
ポリマーベースの検出法は、ビオチンベースの検出法より高感度です。 パラフィン包埋ヒト肺がん組織切片に反応させたSox2 (D6D9) XP® Rabbit mAb #3579を、ビオチンベースの検出法 (左図) またはポリマーベースの検出法 (SignalStain® Boost IHC Detection Reagent #8114、右図) で可視化しました。ポリマーベースの方が感度が高く、より強いシグナルが得られることが分かります。
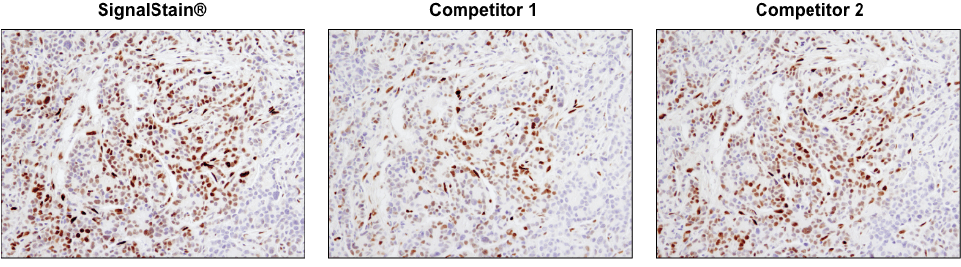
すべてのDAB基質が同じように機能するとは限りません。 パラフィン包埋ヒト乳がん組織をPhospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145を用いてIHCでか解析しました。発色検出には、SignalStain® DAB Substrate Kit #8059 (左)、他社 (Company 1) のDAB発色製品 (中央)、別の他社 (Company 2) のDAB発色製品 (右) を使用し、比較検証しました。Competitor 2のDABでは、SignalStain® DAB Substrate Kitに匹敵するシグナルが得られていますが、Competitor 1のDABでは、シグナルがかなり弱くなっています。
解析対象のタンパク質の免疫標識に重ねて対比染色を行うことで、特定の細胞構造を可視化することができます。対比染色では主に、細胞体、核、その他の細胞内小器官を染色し、可視化します。標的タンパク質の標識と対比染色を組み合わせることで、細胞の特定のコンパートメントへの局在性を検討することができます。これは、免疫染色が標的タンパク質を正確に染色しているかどうかの特異性の検証に利用することができます。また、標的タンパク質の局在性の異常を病理学的に解析する場合に役立つこともあります。
一般的な対比染色液
| 対比染色 | 標的 | 色 |
|---|---|---|
| Hematoxylin | 核 | 青 |
| Methyl Green | 核 | 緑 |
| Nuclear Fast Red | 核 | ピンク |
ここまでで、ようやく実験結果を得ることができます。発色ベースの検出法を利用した場合、呈色反応で染色された組織サンプルは、光学顕微鏡を用いて観察します。一方、蛍光ベースの検出法を利用した場合は、色素を適切に励起し、蛍光を検出する蛍光顕微鏡を用いて観察します。どちらの方法で検出した場合も、まず標的タンパク質の発現が知られているサンプルと、シグナルのないネガティブコントロールを観察することをお薦めします。そうすることで、標的タンパク質を可視化しつつ、バックグラウンドシグナルを最小限に抑えるための適切な設定を確立することができます。定量的な解析を行う場合、理想的には解析対象となるサンプルをすべて同時に染色し、イメージングする必要があります。発色または蛍光シグナルの強度は、画像解析ソフト (ImageJなど) で解析し、定量化することができます。ポジティブコントロールとネガティブコントロールを利用することで、実験の最適化と標準化を行うことができ、得られた結果が正確であることを確認できます。
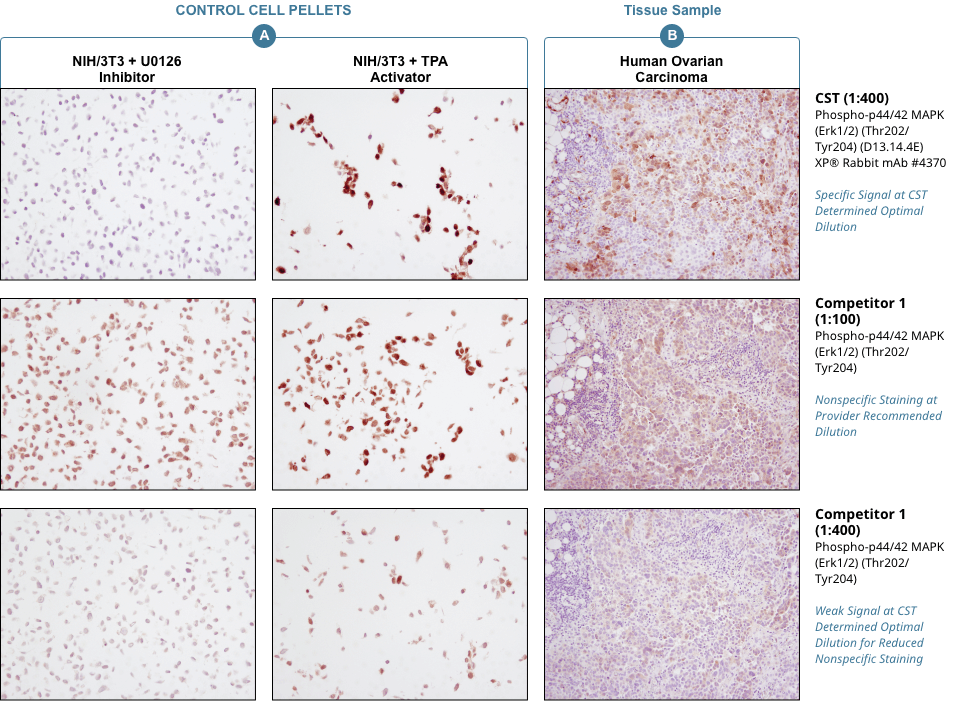
シグナルの特異性を裏付けるには、適切なコントロールが必要です。 Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb #4370を、他社のIHC用Phospho-p44/42 (Tyr202/Tyr204) Antibodyと比較しました。NIH/3T3細胞を阻害剤 (U0126) 処理した場合 (左) で非特異的な染色の最小化、活性化剤 (TPA #4174) 処理した場合 (右) で特異的なシグナルを最大化することで、各抗体の最適な希釈率をそれぞれ評価しました。決定した各抗体の最適希釈率で、パラフィン包埋したヒト卵巣がんのIHC解析を行いました (B)。推奨の希釈率で他社の抗体を使用すると、阻害剤で処理した細胞 (NIH/3T3+U0126) も染色されていることが分かります。CSTが決定した最適希釈率で他社の抗体を使用すると、阻害剤で処理した細胞は染色されませんが、組織も有意に染色されません。CST抗体は、細胞と組織のどちらも、正確に染色します。
マルチプレックスは、1つのサンプル内の複数のタンパク質の標的を一度に可視化できます。これは量に限りのある貴重なサンプルを使うときや、タンパク質の相互作用または共局在化について知りたいとき、特に有益です。しかし、マルチプレックスIHC実験では高度な最適化を必要とします。重要なことは、異なる種の一次抗体またはアイソタイプを選択し、二次抗体の交差反応性を最小限に抑えることです。また、蛍光による検出を行う場合、二次抗体はスペクトルの重複しない蛍光色素分子で標識する必要があります。一方、発色による検出を行う場合は、二次抗体を酵素-基質相互作用が重複しないように標識し、発色基質の色の重複も避けてデザインする必要があります。一次抗体と二次抗体が意図した通りに結合していることを確認するため、次のようなコントロールを含める必要があります:抗体なしコントロール、一次抗体のみのコントロール、二次抗体のみのコントロール。これらを比較して、一次抗体、二次抗体の交差反応がないことを確認します。蛍光マルチプレックス法に関する詳しい情報はこちらをご覧ください。
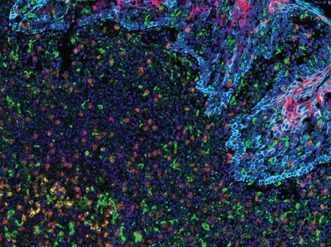
扁桃腺のFFPEサンプルを、PD-L2 (橙)、PD-L1 (E1L3N®)-(赤)、CD68 (緑)、PD-1 (黄)、CD8α (マゼンダ)、Pan-Keratin (シアン) で多重染色し、マルチプレックス解析しました。
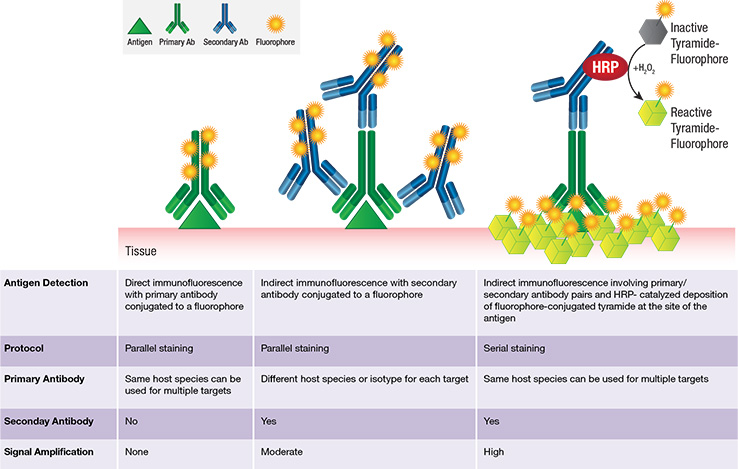
マルチプレックスのオプション
チラミドを用いた蛍光mIHC:概説
IHCは応用範囲の広い強力な解析手段です。他の手法と同様に、適切なコントロールを利用してプロトコールを最適化することで、最良の結果を得ることができます。医療診断から生物医学研究における使用まで、ハイスループット解析からロースループット解析まで、IHCは様々な科学的知見を与え続けています。
アプリケーションノート:
マルチプレックス免疫組織化学染色を用いて免疫チェックポイントタンパク質とT細胞の疲弊を解析する
アプリケーションノート:
マルチプレックスIHC利用した免疫抑制性の腫瘍微小環境を特性解析
ポスター:
高度なマルチプレックスIHCを用いた免疫チェックポイントと免疫療法のバイオマーカーの解析
ポスター:
Multiplex IHC Detection of Immune Checkpoint Receptors in the Tumor Microenvironment