View in English?
View in English?
生物学のセントラルドグマでは、RNAはDNAに含まれるゲノム情報をタンパク質に翻訳する分子と定義されています。しかし、この単純な考え方は、RNA機能の複雑さを考慮していません。RNAのクロスリンク免疫沈降 (CLIP) と次世代シーケンシングを組み合わせた手法などの、新たな試薬や技術の開発により、トランスクリプトーム全体の解析が可能となり、この新しい分野の研究が飛躍的に発展しました。その結果、RNA調節が、様々な疾患の進行にどのように関与するのかといった新たな知見が得られました。
転写後、メッセンジャーRNA (mRNA) はRNA結合タンパク質 (RBP) と相互作用して、特定のmRNAの運命を調節するメッセンジャーリボ核タンパク質 (mRNP) 複合体を形成します (1)。この調節には、キャッピング、スプライシング、輸送、安定性、サイレンシング、分解、翻訳などが含まれます (1, 2)。アデノシンおよびシトシンのメチル化、アデノシンからイノシンへの編集、およびシュードウリジル化など、RNAの転写後修飾を指すエピトランスクリプトミクスは、mRNAの運命に影響を及ぼす重要な役割を果たし、遺伝子発現の調節に別の複雑さの階層を加えます。
N6-メチルアデノシン (m6A) は最もよく見られ、また理解されているRNA修飾であり、ヒストン修飾と同様に、m6Aに特異的なライター、リーダーおよびイレイサーがあります。m6AはMETTL3/METTL4メチルトランスフェラーゼ複合体によって形成され、YTHDC、YTHDF、eIF3などのm6A結合タンパク質と相互作用します。これらの相互作用は、翻訳やRNA安定性の促進など、m6A依存性の細胞イベントを仲介します。m6A修飾は、FTOやALKBH5などの脱メチル化酵素により元に戻されます。m6A修飾は、発生、T細胞のホメオスタシスおよび胚性幹細胞の多能性に役割を果たすことが示されています (3)。
m6A修飾の異常は様々ながんに関与しています (4)。ライター、リーダーおよびイレイサーによる腫瘍形成の促進などのメカニズムは、影響を受ける標的mRNAとがんのタイプに特異的であると思われます。例えば、急性骨髄性白血病 (AML) でのMETTL3の増加は抗アポトーシスがん遺伝子BCL-2の過剰発現を引き起こし、膠芽腫でのMETTL3の減少はがん遺伝子ADAM19の発現上昇を引き起こします。
m6A修飾はまた、パーキンソン病 (PD) の特性であるドーパミン作動性神経細胞死にも関与していることが分かっています (5)。PDラットの脳の線条体ではゲノム全体でのm6Aの減少が観察され、ドーパミン作動性細胞でのFTOの過剰発現がNMDA受容体1の発現を誘導し、酸化ストレスとCa2+の量を増加させてアポトーシスを誘導しています。FTO遺伝子のイントロン1とイントロン2の遺伝子変異体は、アルツハイマー病 (AD) とも関連しています。ヨーロッパ系白人とカリブ諸島のヒスパニック系にこれらの領域のSNPが見出されています。FTOの発現は、AD患者でもコントロールより低いレベルでした (6)。
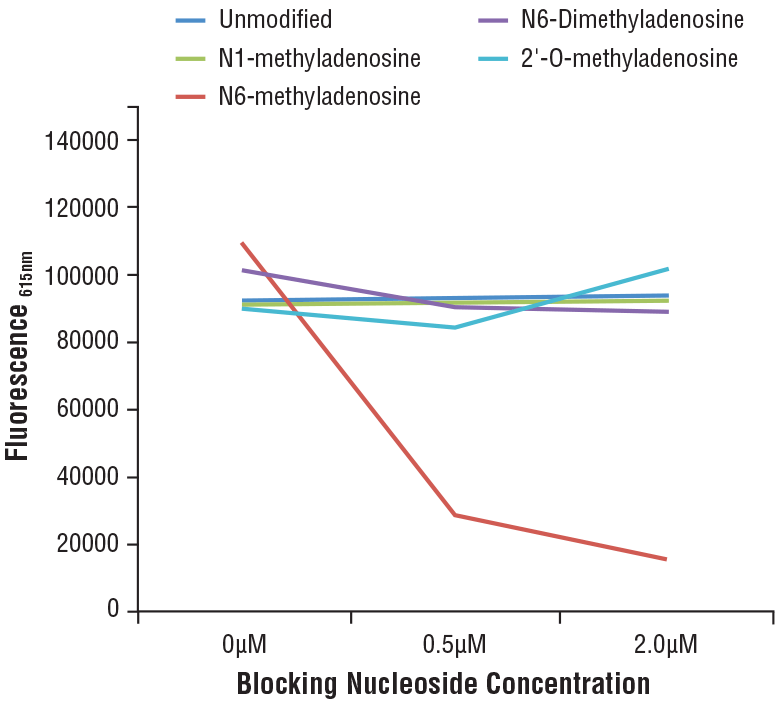
N6-Methyladenosine (m6A) (D9D9W) Rabbit mAb #56593: N6-Methyladenosine (m6A) (D9D9W) Rabbit mAbの特異性は、競合ELISAで決定しました。グラフは、修飾アデノシンの濃度を差次的に増加させた時のプレコートしたm6Aオリゴヌクレオチドへの抗体の結合を示しています。ここで示すように、抗体の結合は遊離のm6Aヌクレオシドによってのみ阻害されます。
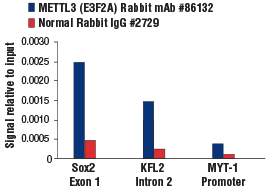
METTL3 (E3F2A) Rabbit mAb #86132: クロスリンクさせたmES細胞由来のクロマチンに、METTL3 (E3F2A) Rabbit mAbあるいはNormal Rabbit IgG #2729のいずれかを用いて、SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を使用してクロマチン免疫沈降を実施しました。SimpleChIP® Mouse Sox2 Exon1 Primers #30180、mouse KLF2 intron 2 primers、SimpleChIP® Mouse MYT-1 Promoter Primers #8985を用いたリアルタイムPCRにより、濃縮したDNAを定量しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。
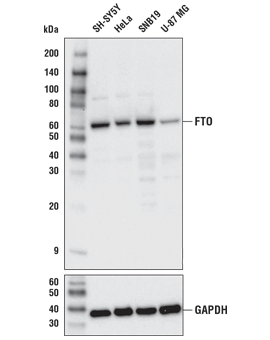
FTO (D6Z8W) Rabbit mAb #31687: 様々な細胞株からの抽出物を、FTO (D6Z8W) Rabbit mAb (上) あるいはGAPDH (D16H11) XP® Rabbit mAb #5174 (下) を用いてウェスタンブロッティングで解析しました。
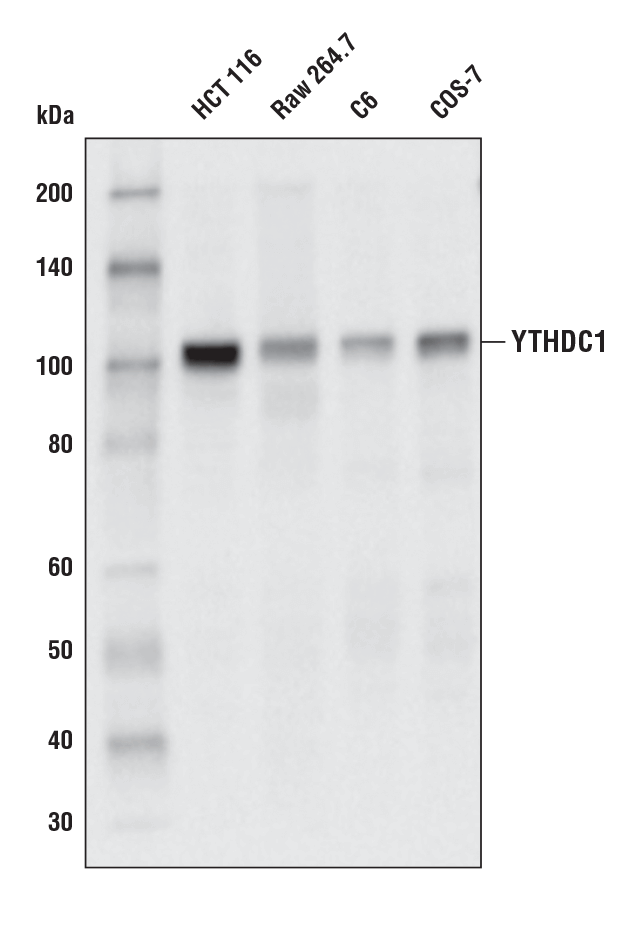
YTHDC1 (E4I9E) Rabbit mAb #77422: 様々な細胞株からの抽出物を、YTHDC1 (E4I9E) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
mRNAは、N7-メチルグアノシン (m7G) 修飾を5’末端に持つことによって開始因子をリクルートし、細胞が自己mRNAとウイルス性mRNAを区別できるようにします。m7Gキャップの次のヌクレオチドである2′-O-メチルアデノシン (Am) が、ライターであるCAPAM/PCIF1によってさらにメチル化されてN6,2′-O-ジメチルアデノシン (m6Am) が形成されることで、可逆的なメチル修飾が生じます (7)。このメチル基はその後、m6AmのイレイサーであるFTOによって除去されます。CAPAM/PCIF1によるメチル化はキャッピングされたmRNAの翻訳を促進するという研究がある一方、m6Am修飾RNAは対応するAm修飾RNAと比べ安定性が高いという研究もあります。
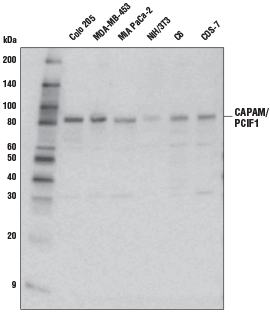
CAPAM/PCIF1 Antibody #98085: 様々な細胞株からの抽出物を、CAPAM/PCIF1 Antibodyを用いてウェスタンブロッティングで解析しました。
m6Aやm6Amとは異なり、N1-メチルアデノシン (m1A) 修飾はワトソン‐クリック型塩基対を妨害し、タンパク質とRNAの相互作用に干渉する可能性があります (8)。また、tRNAとrRNAの安定性を調節するとも考えられています。この修飾は同定が難しいため、m6A修飾やm6Am修飾と比べ、あまりよく知られていません。使われたシーケンシング技術が違ったこと、また豊富に検出した研究グループもまったく検出しなかった研究グループもあるため、mRNAにおけるm1A修飾の存在は決定的なものではありません。mRNAのm1A修飾を観察した研究グループは、m1AのイレイサーとしてALKBH3を同定していますが、m1Aのライターはまだ同定されていません (9)。
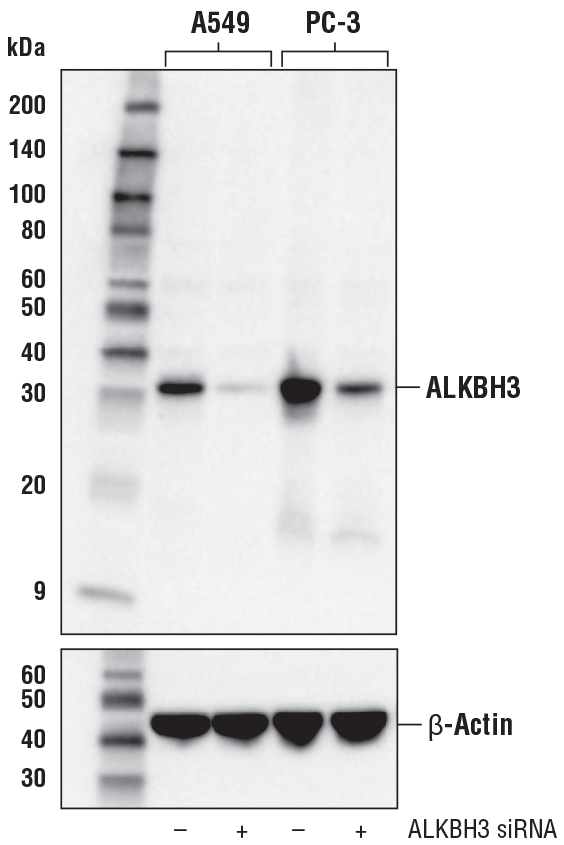
ALKBH3 (E6S4R) Rabbit mAb #87620: モックトランスフェクト (-) あるいはALKBH3 siRNAでトランスフェクト (+) した、A549細胞およびPC-3細胞からの抽出物を、ALKBH3 (E6S4R) Rabbit mAb (上) あるいはβ-Actin (D6A8) Rabbit mAb #8457 (下) を用いてウェスタンブロッティングで解析しました。
シュードウリジンは、ウラシルの窒素-炭素結合が炭素-炭素結合に置換された修飾です。Dyskerinなどのシュードウリジンシンターゼ (PUSタンパク質) は、主にtRNAにてこの変化を触媒してtRNAの安定性を促進します (10)。PUSタンパク質はrRNAも修飾し、タンパク質の適切な合成に必要なリボソームの構築を手助けします。mRNAのシュードウリジル化は最近見出されたばかりであり、これはmRNAのスプライシング、翻訳、半減期、および翻訳調節に影響を及ぼす可能性があります。
Dyskerinタンパク質の異常な活性は、がんの進行および患者の予後不良と相関しています。シュードウリジル化はHIV感染におけるウイルス潜伏プロセスの調節にも役割を果たし、クローン病、セリアック病、X連鎖先天性角化不全症 (X-DC)、難聴を伴った母系遺伝糖尿病 (MIDD)、ミトコンドリアミオパシーおよび鉄芽球性貧血 (MLASA) などにも関与しています。
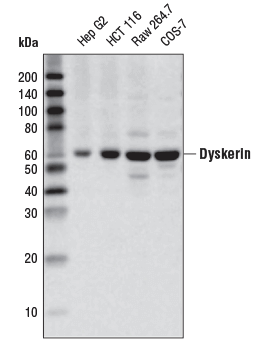
Dyskerin (D6N4K) Rabbit mAb #53234: 様々な細胞株からの抽出物を、Dyskerin (D6N4K) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
RNAに作用するアデノシンデアミナーゼ (ADAR) は、アデノシンの脱アミノ化を触媒しmRNA前駆体にてイノシンを形成します。A-to-I編集としても知られるこの反応は、RNAスプライシングとRNAの成熟化を変化させ、タンパク質のコードと機能の変化の原因となることがあります。さらに最近の研究によって、A-to-I編集は自己のRNAに対する自然免疫応答を回避させることが示されました (11)。ADAR1による編集は2本鎖RNA (dsRNA) を不安定化し、非自己物質の認識と除去に関与する監視タンパク質であるRIG-IとMDA5の活性化を抑制します。
A-to-I編集は、AZIN1などのタンパク質のコードや性質を変化させることによりがんの進行に寄与します。AZIN1がA-to-I編集を受けると367番目の残基であるセリンがグリシンに置換され、これによって細胞運動、浸潤および転移の促進に働く複数のがんタンパク質の分解が抑制されます。さらに、がん細胞でのADAR1の欠損あるいはノックダウンは、がん免疫療法への耐性を打破します (12)。
A-to-I編集はHIV感染を調節するように見えます。しかし、これがどのように疾患を調節するかについては、まだコンセンサスがありません。HIV-1 RNAのA-to-I編集はウイルスのアセンブリーを妨げ一次マクロファージの増殖を阻害することが示されていますが、ADAR1活性の上昇はCD4陽性T細胞におけるHIV-1ウイルス複製の増加と相関しています (11)。HIV感染に対するA-to-I編集の効果を理解するには、さらなる研究が必要です。
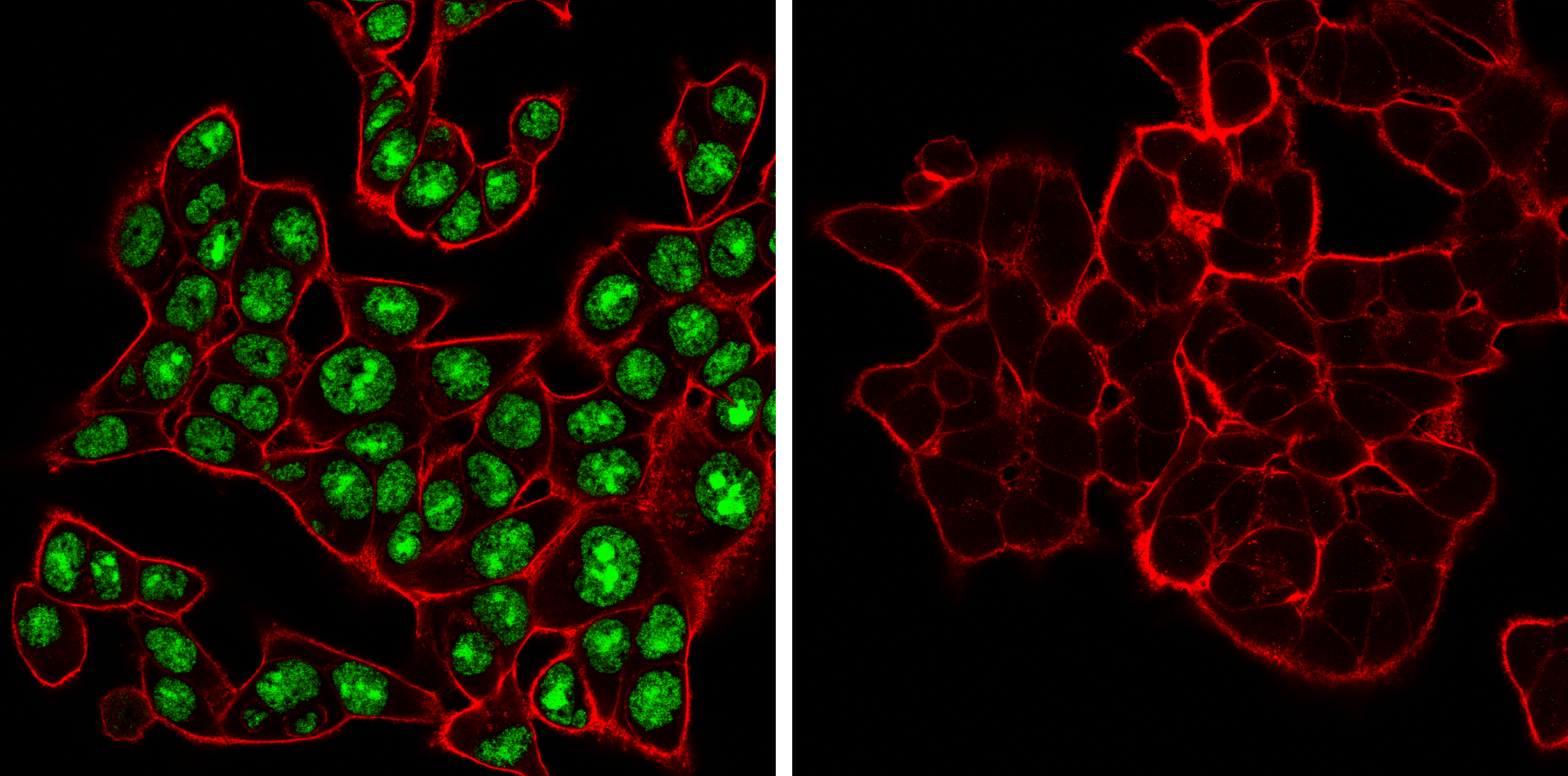
ADAR (E6X9R) XP® Rabbit mAb #81284: 野生型 (左、ポジティブ) あるいはADAR1ノックアウト (右、ネガティブ) HCT 116細胞を、ADAR1 (E6X9R) XP® Rabbit mAb (緑) を用いて免疫蛍光染色し、共焦点顕微鏡で解析しました。アクチンフィラメントは、DyLight650 Phalloidin #12956 (赤) で染色しました。
選択的スプライシングは、1つの遺伝子から代替のmRNA転写産物が生成される調節されたプロセスであり、その結果、同じタンパク質の異なるアイソフォームが翻訳され、これは異なる機能、結合パートナー、細胞内局在を持つ原因となります。選択的スプライシングの基本モードには、構成的スプライシング、イントロン保持、エキソンスキッピング、選択的スプライシング部位の選択、相互排他的なスプライシング、代替のプロモーターの選択、および代替のポリアデニル化部位などがあります (13)。選択的スプライシングは、PTBP1などのタンパク質や、mRNA前駆体に結合しスプライソソームによって触媒されるhnRNP A1などのヘテロ核リボ核タンパク質によって調節されます。
スプライソソームは真核細胞の核に存在する、小さな核RNA (snRNA) とタンパク質から成る大きな分子機械です。主要なスプライソソームは真核細胞で最も豊富であり、U1、U2、U4、U5、およびU6 snRNAを含むsnRNPを持ちますが、その他のスプライソソームはあまり一般的ではなく、U11、U12、U4atac、U4、およびU5 snRNAを含むsnRNPを持ちます (14)。スプライソソームは、mRNA前駆体にて5’末端スプライス部位などの異なる配列を認識して、非コードイントロンを取り除き隣接するエキソンを再度繋ぎ合わせて、成熟しスプライシングされたmRNAを形成します。核となるスプライソソームはまた、選択的スプライシングを補助するため、SAM68などのタンパク質もリクルートします。
SAM68は、CD44 mRNAやその他のRNAの選択的スプライシングを調節するRBPです。SAM68とその選択的スプライシングの標的の活性の多くは、脊髄性筋萎縮症やがんの発生と関連しています (15)。RNAのスプライシング、安定性、輸送を調節するタンパク質であるTDP-43は、異常にユビキチン化、リン酸化、切断されており、前頭側頭葉変性症および筋萎縮性側索硬化症の患者で不溶性凝集体を形成する断片を生じます (16)。さらに、ATP依存性スプライシング因子であるUAP56もまた、転移性去勢抵抗性前立腺がんとの関連があるアンドロゲン受容体AR-V7のスプライスバリアントを促進します (17, 18)。がんの進行や治療への耐性に主要な役割を果たすことが知られている他のスプライスバリアントとして、様々ながんに関連する12の異なるp53スプライスバリアントなどがあります (19)。臨床試験では、p53アイソフォームの発現プロファイルが腫瘍の進行と臨床的な応答に関連している可能性が示されています。
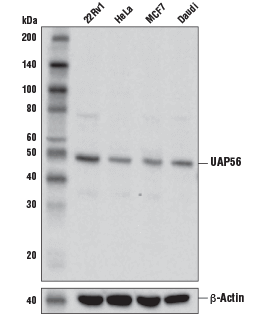
UAP56 Antibody #55509: 様々な細胞株からの抽出物を、UAP56 Antibody (上) あるいはβ-Actin (D6A8) Rabbit mAb #8457 (下) を用いてウェスタンブロッティングで解析しました。
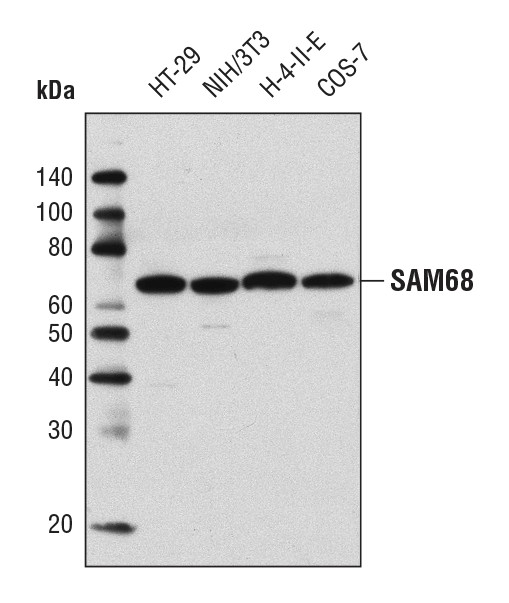
SAM68 Antibody #12538: 様々な細胞株からの抽出物を、SAM68 Antibodyを用いてウェスタンブロッティングで解析しました。
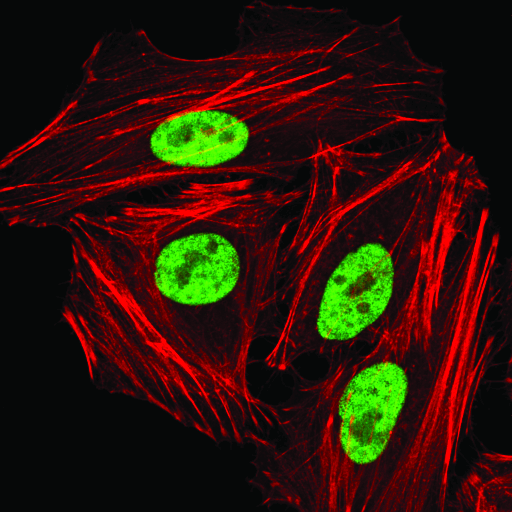
hnRNP A1 (D21H11) Rabbit mAb #8443: HeLa細胞を、hnRNP A1 (D21H1) Rabbit mAb (緑) を用いて免疫蛍光染色し、共焦点顕微鏡で解析しました。アクチンフィラメントは、DyLight554 Phalloidin #13054 (赤) で染色しました。
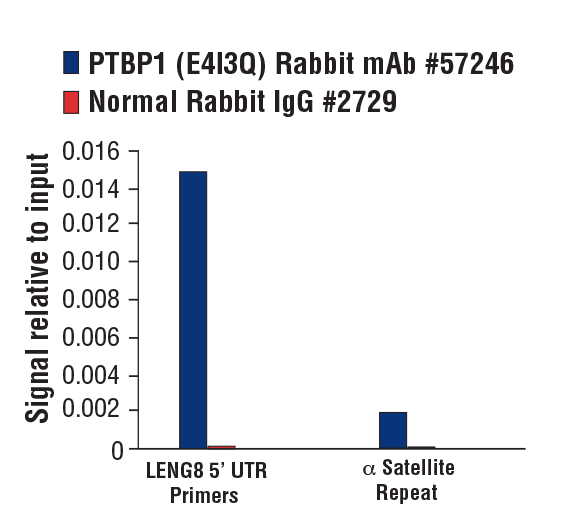
PTBP1 (E4I3Q) Rabbit mAb #57246: フェノールレッドを含まない培地と5%活性炭で処理したFBSで4日間培養した後、β-Estradiol 10 nMで45分間処理したMCF7細胞由来のクロスリンクさせたクロマチンに、PTBP1 (E4I3Q) Rabbit mAbあるいはNormal Rabbit IgG #2729のいずれかを用いて、SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を使用してクロマチン免疫沈降を実施しました。SimpleChIP® Human LENG8 5’ UTR Primers #70823およびSimpleChIP® Human α Satellite Repeat Primers #4486を用いたリアルタイムPCRにより、濃縮したDNAを定量しました。インプットクロマチンの総量を1とし、各サンプルで得られたDNA量の相対値を示しています。
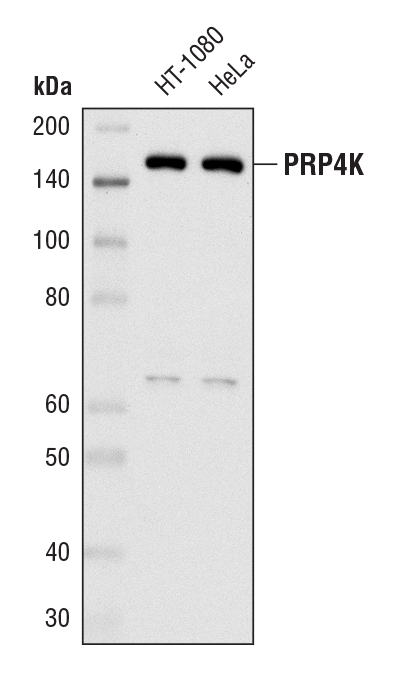
PRP4K (D27A1) Rabbit mAb #8577: HT-1080細胞およびHeLa細胞からの抽出物を、PRP4K (D27A1) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
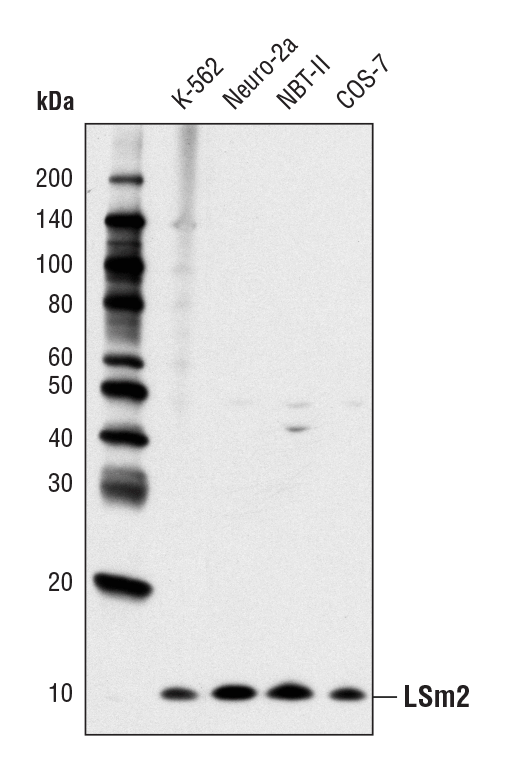
LSm2 (D9X6C) Rabbit mAb #13119: 様々な細胞株からの抽出物を、LSm2 (D9X6C) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
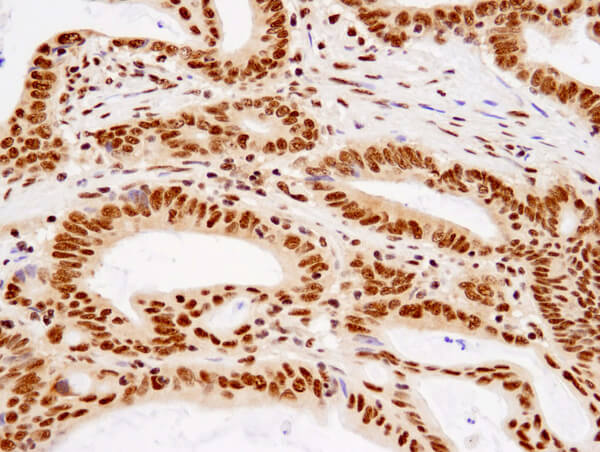
TDP43 (D9R3L) Rabbit mAb #89789: パラフィン包埋ヒト結腸がんをTDP43 (D9R3L) Rabbit mAbを用いて免疫組織化学染色し、解析しました。
miRNAは、標的mRNAを分解あるいは発現阻害し、転写後の遺伝子発現を調節するノンコーディングRNAです (20)。これらはRNAポリメラーゼIIにより一次miRNA (pri-mRNA) に転写された後、核でDroshaとDGCR8によって切断されてmiRNA前駆体を形成します。短いヘアピンを持つこのmiRNA前駆体は、その後、XPO5によって細胞質に輸送され、そこでさらにDicerによる切断を受けて成熟miRNAになります。成熟miRNAはArgonaute 2 (AGO2) やTRBPなどのタンパク質と相互作用して、RISC (RNA-induced silencing complex) を形成します。RISC依存性の遺伝子発現抑制は、mRNAの分解あるいは翻訳阻害によって起こります。
AGO2、DroshaおよびDGCR8の発現変化などのmiRNA機構の障害は、多数の疾患にて発がんを促進することが判明しています。miRNAの調節不全は心臓病や腎臓病にも関連しています (21, 22)。
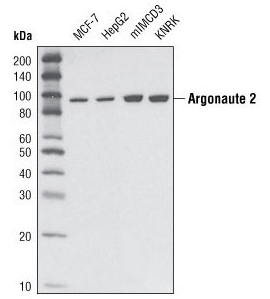
Argonaute 2 (C34C6) Rabbit mAb #2897: 様々な細胞株からの抽出物を、Argonaute 2 (C34C6) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
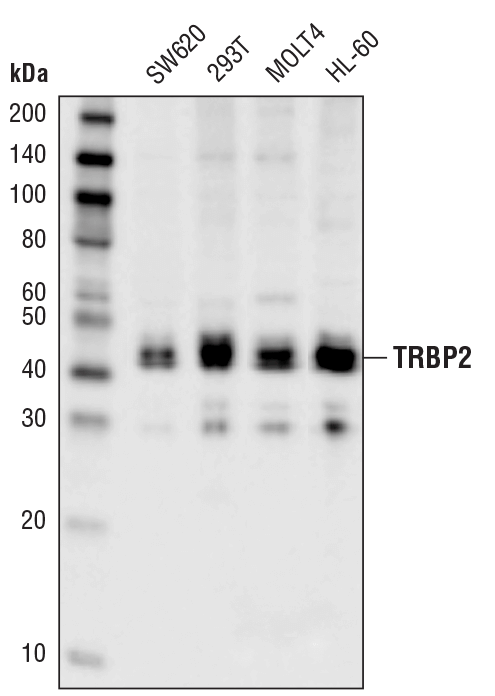
TRBP2 (D7C8K) Rabbit mAb #62043: 様々な細胞株からの抽出物を、TRBP2 (D7C8K) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
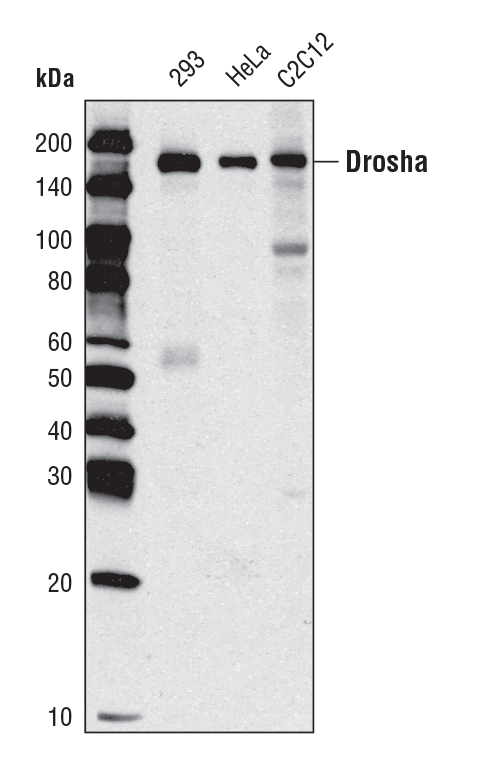
Drosha (D28B1) Rabbit mAb #3364: 様々な細胞株からの抽出物を、Drosha (D 28B1) Rabbit mAbを用いてウェスタンブロッティングで解析しました。

Dicer (D38E7) Rabbit mAb #5362: MCF7細胞および293細胞からの抽出物を、Dicer (D38E7) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
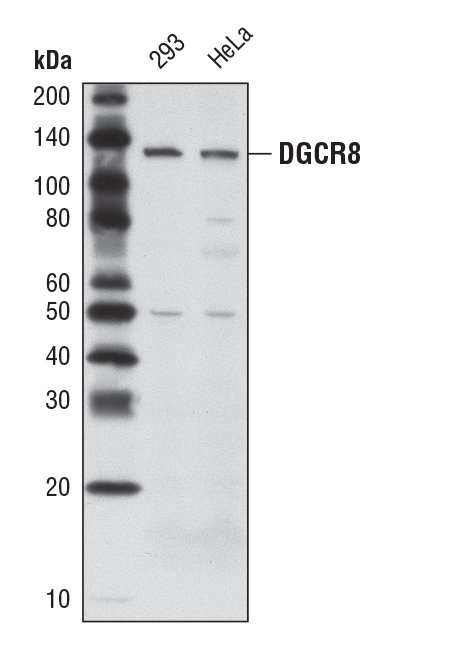
DGCR8 (D78E4) Rabbit mAb #6914: 293細胞およびHeLa細胞からの抽出物を、DGCR8 (D78E4) Rabbit mAbを用いてウェスタンブロッティングで解析しました。
mRNAはRBPと相互作用し、mRNAの局在、安定性および翻訳を調節するmRNP顆粒を形成します。多種多様な顆粒のうち、ストレス顆粒とP-body (processing body) が最もよく研究されています (23)。P-bodyは、脱キャッピング酵素、翻訳調節因子、miRNA機構、およびナンセンス変異依存分解 (NMD) に関連する因子を含む細胞質RNA顆粒です。ストレス顆粒は、細胞ストレスが負荷された際に特定のmRNAを保護し、伸長因子、リボソーム40Sサブユニット、および翻訳停止したmRNAを含みます。ストレス顆粒は、ストレス誘導性のeIF2リン酸化に応答して形成されます。RasGAPのSH3ドメインと相互作用するタンパク質であるG3BP1は、ストレス顆粒の構築およびストレス顆粒の核となるタンパク質としての機能に不可欠であるため、ストレス顆粒のマーカーとしてよく使われます (24)。
ストレス顆粒の異常あるいは持続的な形成は、筋萎縮性側索硬化症、パジェット病、および前頭側頭葉変性症などの変性疾患に寄与する可能性があります (25)。このような病的状態に陥った細胞は、ストレス顆粒と同じ構成因子を多く含む封入体を持ちます。さらに、このような疾患に関与する変異タンパク質の多くは、ストレス顆粒に局在するか、異常なストレス顆粒の形成を促進します。ストレス顆粒とがんの関係を示唆する証拠もありますが、疾患の進行を促進するメカニズムは依然として解明されていません (23)。
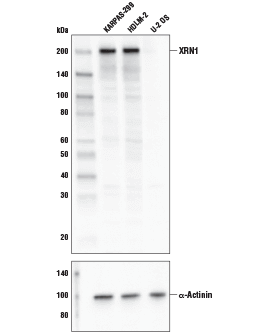
XRN1 Antibody #70205: KARPAS-299細胞株、HDLM-2細胞株、U-2 OS細胞株からの抽出物を、XRN1 Antibody (上) あるいはα-Actinin (D6F6) XP® Rabbit mAb #6487 (下) を用いてウェスタンブロッティングで解析しました。KARPAS細胞株は、ケンブリッジ大学のAbraham Karpas博士より譲与いただきました。
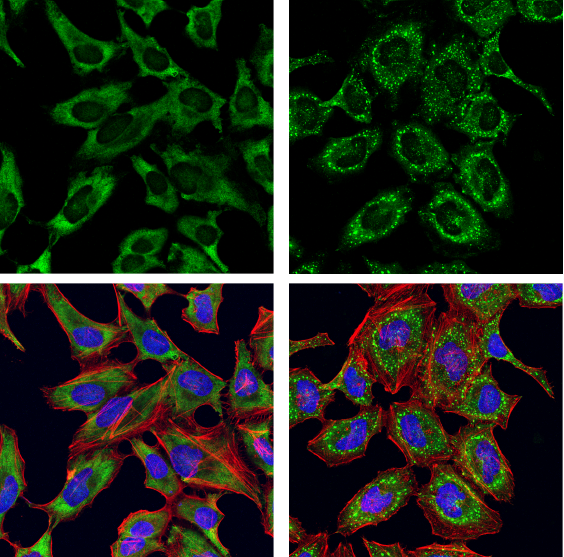
G3BP1 Antibody #17798: 血清飢餓処理 (左) あるいは血清飢餓処理の後に亜ヒ酸ナトリウム500 μMで30分間処理 (右) したHeLa細胞を、G3BP1 Antibody (緑) を用いて免疫蛍光染色し、共焦点顕微鏡で解析しました。アクチンフィラメントは、DyLight554 Phalloidin #13054 (赤) で染色しました。サンプルは、ProLong Gold Antifade Reagent with DAPI #8961 (青) を用いて封入しました。
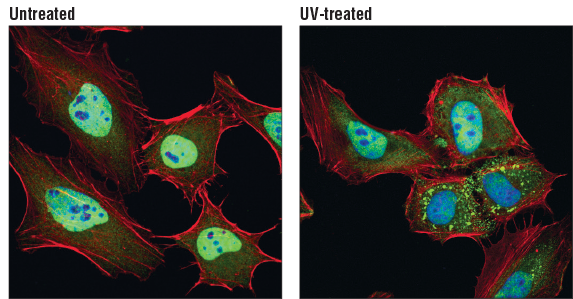
TIAR (D32D3) XP® Rabbit mAb #8509: 未処理 (左) あるいはUV処理 (右) したHeLa細胞を、TIAR (D32D3) XP® Rabbit mAb (緑) を用いて免疫蛍光染色し、共焦点顕微鏡で解析しました。アクチンフィラメントは、DyLight554 Phalloidin #13054 (赤) で染色しました。DRAQ5 #4084 (蛍光DNA染料) は青の疑似カラーで示しています。
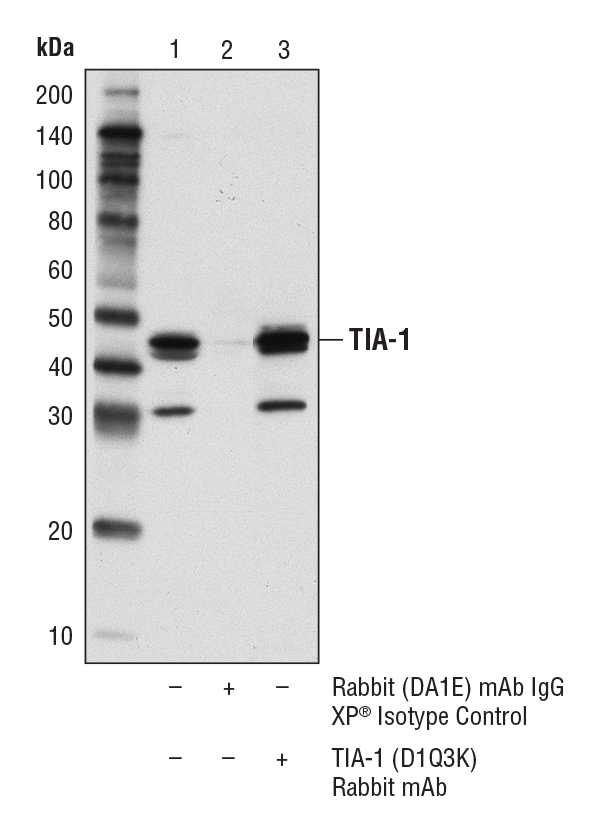
TIA-1 (D1Q3K) Rabbit mAb #86050: KARPAS-299細胞ライセートを、TIA-1を用いて免疫沈降しました。レーン1は10%インプット、レーン2はRabbit (DA1E) mAb IgG XP® Isotype Control #3900、レーン3はTIA-1 (D1Q3K) Rabbit mAbを用いています。ウェスタンブロッティングはTIA-1 (D1Q3K) Rabbit mAbを用いて実施しました。IgGとの交差反応を避けるため、立体配座特異的な二次抗体を使っています。KARPAS細胞株は、ケンブリッジ大学のAbraham Karpas博士より譲与いただきました。