View in English?
View in English?
CSTのフローサイトメトリー検証済み製品は、生物学的に適切なモデルを用いて厳格な試験を実施しています。この試験で、標識抗体、非標識抗体ともに、特異性の確認と、最適なシグナル・ノイズ比 (S/N) の検証を行なっています。異なる用途の検証も行うことによって、抗体の特異性をさらに確認します。また、最適希釈率、特異性、安定性、ロットごとの再現性の検証を全ての抗体で実施しており、これらを用いて常に安定した結果が得られることを確認しています。
徹底的に検証されたCSTのフローサイトメトリー用抗体は、細胞株、組織懸濁液、穿刺液、または血液試料における複雑な細胞内シグナル伝達カスケードの解析に用いることが可能で、お客様の実験結果をさらに高精度で信頼度の高いものにします。
CST抗体のパフォーマンスは、日常的に複数プラットフォームに渡って検証されています。下記は、このようなテストが必要な理由を示す一例です。
フローサイトメトリーと免疫蛍光染色における比較解析。これにより、CST抗体の高い特異性が確認できます。シグナル強度はそれほど強くないものの、細胞の核コンパートメントが正しく染色されています。
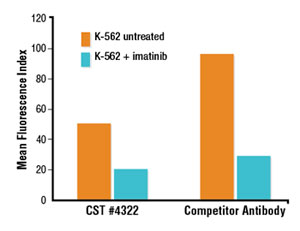
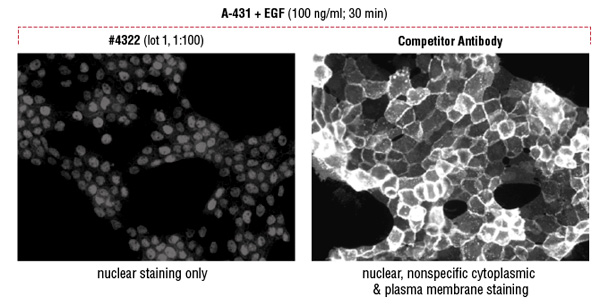
他社製品Phospho-Stat5 (Tyr694) 抗体を用いたフローサイトメトリー解析で、Phospho-Stat5 (Tyr694) (D47E7) XP® Rabbit mAb #4322のものより強いシグナルが検出されました (A)。しかしながら、免疫蛍光染色による解析で、他社製品では細胞質と細胞膜に不適切な染色がみられます。一方で、#4322では核のみの適切な染色がみられました (B)。
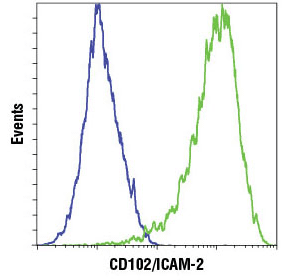
HeLa細胞 (青) と、HUVEC細胞 (緑) を用い、CD102/ICAM-2 (D7P2Q) Rabbit mAb #13355の、フローサイトメトリーにおける特異的な反応性を検証しました。二次抗体には、Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) #4414を用いました。
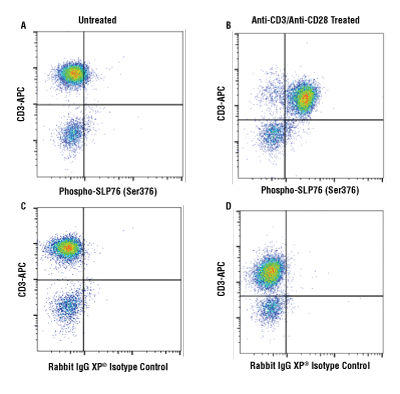
Cross-linked anti-CD3 plus anti-CD28処理 (それぞれ10 μg/mL、15分間) したヒト末梢血単核細胞 (B、D) と、未処理の細胞 (A、C) を調製しました。Phospho-SLP-76 (Ser376) (D7S1K) XP®Rabbit mAb #92711を用いてこれらの細胞をフローサイトメトリー解析し (A、B)、同一濃度のRabbit (DA1E) mAb IgG XP® Isotype Control #3900を用いた場合 (C、D) と比較し、特異的な反応性を検証しました。これらの細胞は、同時にCD3抗体で染色しました。二次抗体にはAnti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) #4412 を用いました。
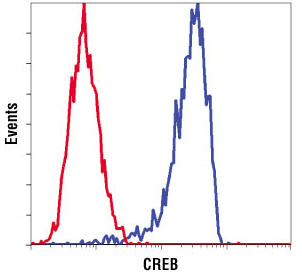
SH-SY5Y細胞を、CREB (D76D11) Rabbit mAb Antibody #4820 (青) と、同一濃度の Rabbit (DA1E) mAb IgG XP® Isotype Control #3900 (赤) を用いてフローサイトメトリー解析し、結果を比較しました。#3900は、非特異的結合 (バックグラウンド) を示すネガティブコントロールです。
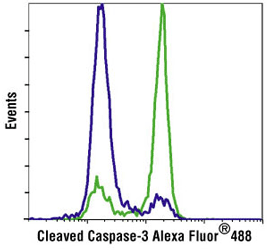
Etoposide #2200処理したJurkat細胞 (緑) と、未処理 (青) の細胞を、Cleaved Caspase-3 (Asp175) Antibody (Alexa Fluor® 488 Conjugate) #9669を用いてフローサイトメトリー解析しました。
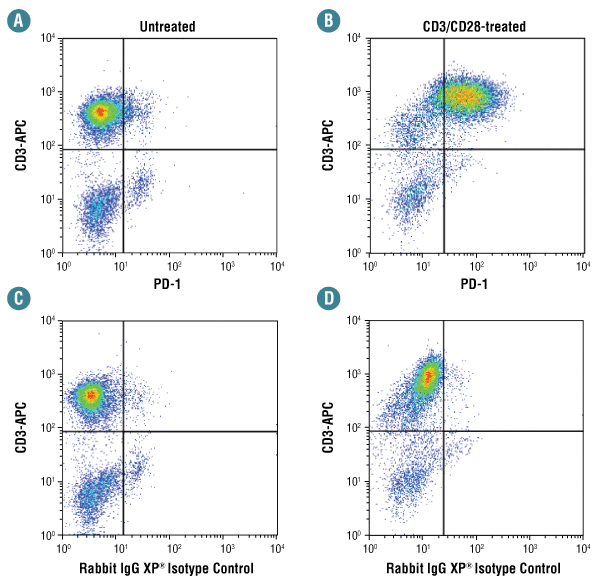
anti-CD3/CD28で72時間処理したヒト末梢血単核細胞 (B、D) と、未処理の細胞 (A、C) を、PD-1 (D4W2J) XP® Rabbit mAb #86163 (A、B) と、同一濃度のRabbit (DA1E) mAb IgG XP® Isotype Control #3900 (C、D) を用いてフローサイトメトリー解析し、結果を比較しました。これらの細胞は同時にCD3抗体で染色しました。
CSTでは、抗体ごとに最適な濃度と染色プロトコールを決定しています。
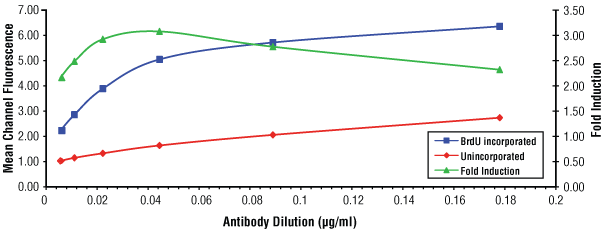
BrdUを30分間取り込ませたJurkat細胞 (青) と、未処理の細胞 (赤) を、段階希釈したBrdU (Bu20a) Mouse mAb #5292を用いてフローサイトメトリーで解析しました。両者の蛍光強度比 (fold-induction) を緑で示しました。この結果から、#5292をフローサイトメトリーで用いる場合の推奨濃度は0.044 µg/mLと決定されました。
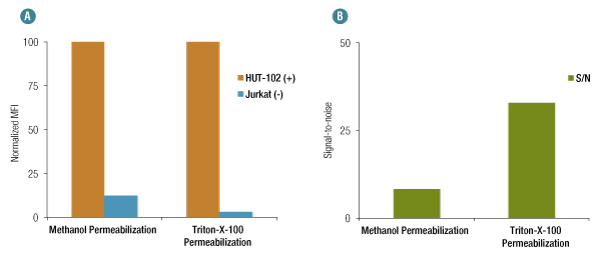
OX40 (D1S6L) Rabbit mAb #15123を用いたフローサイトメトリー解析では、メタノールによる透過化処理をした場合に、ネガティブコントロールのJurkat細胞で、非特異的な結合がみられます (A、ポジティブコントロールのHUT-102細胞で得られる蛍光強度との比にご注意ください)。一方、透過化処理にTriton X-100を用いた場合には、この非特異的な結合の有意な減少がみられ、同一濃度の抗体で染色した場合に高いS/N比が得られます (B)。
Btk (D3H5) Rabbit mAbは、ヒト全血からのB細胞を選択的に単離します。 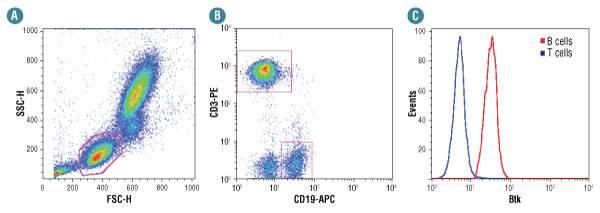
CST Flow Alternateプロトコールに従って、ヒト全血サンプルの固定、赤血球溶解、浸透化処理を行い、Btk (D3H5) Rabbit mAb #8547を用いて染色しました。散乱光の情報から、(A) に示したようにゲートを設定し、また細胞を同時にCD3-PE、CD19-APCで染色することで、T細胞とB細胞のサブポピュレーションを (B) に示したように分離しました。B細胞集団 (赤)、T細胞集団 (青) にそれぞれゲートを設定し、Btkの蛍光強度のヒストグラムを (C) に示しました。二次抗体には、Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) #4412を用いました。