View in English?
View in English?
免疫蛍光染色 (IF) には、特異的な一次抗体と蛍光標識二次抗体を用いて細胞タンパク質をラベルする方法 (間接法) と、直接標識された一次抗体でラベルする方法 (直接法) があります。ほとんどの蛍光顕微鏡で、1つのサンプルで2、3種類の蛍光ラベルしたタンパク質の細胞内局在、相対的な発現レベルと活性化状態 (例:リン酸化状態) を観察することが可能です。多重解析を用いることで、組織中に存在する、複数のマーカー解析が必要な細胞集団の解析で、連続切片を用意する必要が無くなり、時間と試薬を節約できます。Cell Signaling Technology (CST) の科学者は、手動方式の蛍光顕微鏡、自動化イメージング、レーザースキャニングハイコンテントプラットフォームなどのIFアプリケーションで、800もの活性化状態特異的 (例:リン酸化特異的など) 抗体とTotal抗体を検証しています。 免疫蛍光染色アッセイでの使用が推奨されたすべてのCST™抗体は、厳格な検証プロセスに基づいて試験されています。
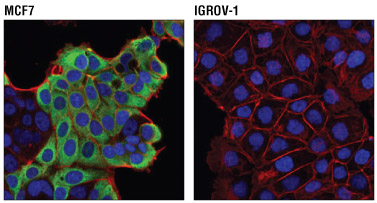
MCF7細胞 (AGR2陽性細胞、左) とIGROV-1細胞 (AGR2陰性、右) を用いた共焦点免疫蛍光解析。細胞をAGR2 (D9V2F) XP® Rabbit mAb #13062 (緑) と β-Actin (8H10D10) Mouse mAb #3700 (赤) で染色し、抗体の特異性を検証しました。DRAQ5® #4084を用いてDNAを染色し、青の擬似カラーで示しました。
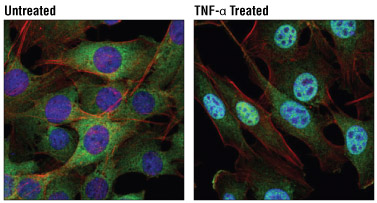
Mouse Tumor Necrosis Factor-α (mTNF-α) #5178で処理 (20 ng/mL、30分間) したC2C12細胞 (右) と、未処理コントロール細胞 (左) の、共焦点免疫蛍光解析。細胞をNF-κB1 p105/p50 (D4P4D) Rabbit mAb #13586 (緑) で染色しました。アクチンフィラメントをDyLight™ 554 Phalloidin #13054 (赤) で染色しました。DRAQ5® #4084を用いてDNAを染色し、青の擬似カラーで示しました。
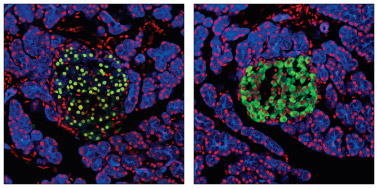
Pdx1 Antibody #2437:正常ラット膵臓の共焦点免疫蛍光解析。組織をPdx1 Antibody #2437 (緑、左) または Insulin (C27C9) Rabbit mAb #3014 (緑、右) で染色しました。また、ケラチン繊維をPan-Keratin (C11) Mouse mAb (Alexa Fluor® 647 Conjugate) #4528 (青) で可視化しました。Propidium Iodide/RNase #4087を用いてDNAを染色し、赤で示しました。
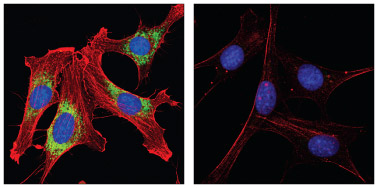
PDI Antibody #2446およびβ-Actin (8H10D10) Mouse mAb #3700:NIH/3T3細胞の共焦点免疫蛍光解析。メタノール (左) または0.3% Triton X-100 (右) で透過化処理し、#2446 (緑) および#3700 (赤) で染色しました。DRAQ5® #4084を用いてDNAを染色し、青の疑似カラーで示しました。