View in English?
View in English?
DNA損傷応答などで見られる、増殖していた細胞が増殖促進刺激に対する抵抗性を獲得し、安定的に細胞周期が停止した状態を細胞の老化と呼びます。細胞老化はもともと、Leonard Hayflick博士によって発見された現象です。Hayflick博士は、ヒト胎児線維芽細胞が一定回数の細胞分裂を経た後に増殖を止めること、増殖を止めた後も細胞は死滅せず、長期間培養した後でも代謝活性を維持する (すなわち生存を継続する) ことを発見し、この現象を細胞の老化と名付けました。現在では、形質転換したがん細胞が無限に増殖するのに対し、正常な細胞は幹細胞様の性質をもつ一部の例外を除き、分裂回数に制限があることが広く知られています。例外的に増殖に制限のない非形質転換細胞には、天然に存在するものとして生殖系列細胞、体性幹細胞、胚性幹細胞 (ES細胞) などがあり、試験管内で制御した条件で作成されたものにiPSC (induced pluripotent stem cells) があります。老化細胞は、細胞周期を再開できる休止期にある細胞や最終分化細胞とは区別されます。
老化細胞の特徴には、形態的な変化、代謝の変化、クロマチンの再構成、遺伝子発現の変化などが挙げられます。近年では、老化した細胞がSASP (Senescence-associated secretory phenotype) と呼ばれる炎症促進性の表現型を獲得することも注目されています。細胞老化の生物学的な役割は非常に複雑で、有益な効果と有害な効果の両方が報告されており、生理的状況によって異なるようです。例えば、細胞老化は損傷を受けた細胞が悪性形質転換し、がん化するのを防ぐ機構であると考えられている一方で、様々な加齢に関わる病態 (組織の変性、炎症性疾患、がんなど) に老化した細胞が関与するという知見もあります。
混同しやすいですが、加齢 (aging) と細胞老化 (cellular senescence) は同一の現象ではありません。加齢は時間の経過に伴って進行的に起こる現象ですが、細胞老化は全生存期間中に起こり得る現象で、胚発生の段階で起こることもあります。老化した細胞の数は加齢と共に増えますが、細胞老化は発生や創傷治癒時にも重要な役割を果たします。
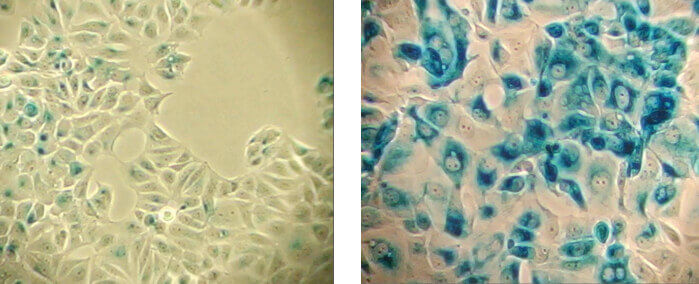
β-ガラクトシダーゼ染色 (青色に染色された細胞) は、pH依存性β-ガラクトシダーゼ活性 (既知の老化細胞の特徴) を検出する手法です。正常細胞 (左パネル)、老化細胞 (右パネル)。
細胞老化は損傷を受けたDNAを持つ細胞の複製を防ぐことで、抗腫瘍効果の役割を果たしていると考えられています。老化は通常、テロメア短縮 (複製老化)、DNA損傷 (DNA損傷誘発性老化)、およびがん遺伝子の活性化 (がん遺伝子誘発性老化) に応答して起こります。
複製老化は、Hayflick博士が発見した、正常細胞をin vitroで培養すると約50回の分裂の後に増殖を止める現象のことで、ヘイフリック限界と呼ばれています。現在、テロメアの短縮が複製老化の原因であると考えられています。DNA複製が起こるたびにテロメア長は徐々に短縮され、最終的には臨界長に達します。すると複製が妨げられ、細胞分裂が止まります。キャップ構造を持たない非常に短いテロメアによってDNA損傷応答が開始され、細胞老化が誘導されます。
DNAの損傷は、損傷の程度と生理学的状況に応じてDNA修復やアポトーシス、細胞老化を誘導します。老化細胞の特徴として、慢性的なATM (Ataxia Telangiectasia mutated)、ATR (Ataxia Telangiectasia and Rad3 related) キナーゼシグナルの活性化など、持続性のDNA損傷応答 (DDR) が挙げられ、これらが最終的にp53/p21、p16/pRbを介して細胞周期の停止と細胞老化を引き起こすと考えられています。電離放射線、化学治療、遺伝毒性ストレス、酸化ストレスなどが持続性のDNAの損傷とそれに続く細胞老化の原因となります。
細胞老化は、がん遺伝子の活性化によって細胞の自律的な抗がん機構として誘導されます。がん遺伝子の活性化によって細胞が形質転換し、がん化するのを防ぐため、細胞の老化が起こると考えられています。がん遺伝子によって誘導される細胞老化 (OIS:incogene-induced senescence) は、原がん遺伝子H-Rasの異常な活性化や、PTENなどのがん抑制遺伝子の不活化によって起こります。例えば、低分子量Gタンパク質H-RASのがん遺伝子型H-RASV12は、慢性的にp38 MAPKシグナル伝達経路を活性化してOISを引き起こします。強い分裂促進シグナルの活性化は、複製ストレス (DNA複製が一時停止した複製フォークを崩壊させる) を介してDNA損傷も誘発します。
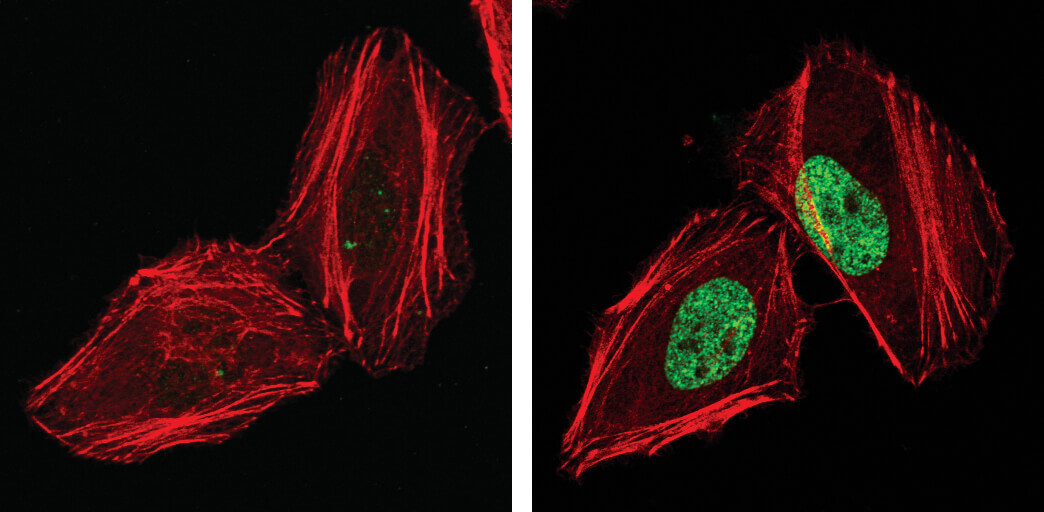
γ-H2A.Xとしても知られるリン酸化Histone H2A.X (Ser139) は、よく利用される細胞老化のマーカーです (右の画像で緑に染色された核)。
老化細胞の特徴には、安定した細胞周期の停止のほか、形態的、代謝的な変化、クロマチンの再構成、遺伝子発現の変化、SASP (senescence-associated secretory phenotype) の獲得などがあります。老化した細胞のすべてが、老化のバイオマーカーを提示するわけではないことに注意する必要があります。さらに、老化バイオマーカーの一部は、例えばアポトーシス細胞や静止細胞でも観察され、必ずしも老化細胞に特異的ではありません。したがって、以下のようないくつかのバイオマーカーを併用することで老化細胞を特定します。
安定した細胞周期の停止
細胞周期を安定的に停止している細胞のみが老化細胞と考えられます。静止細胞と異なり、老化細胞は既知のどのような生理学的刺激を受けても細胞周期を再開することがありません。細胞周期の停止には、下に詳述するp53/p21CIP1とp16INK4A/pRbがん抑制遺伝子経路が関与しています。p16INK4Aの発現は老化細胞でよく見られるので、有用なバイオマーカーとなっています。しかし、p16INK4Aは、pRb陰性腫瘍や細胞株においても高発現が見られます。
形態的および代謝的変化
老化細胞は一般的に、分裂増殖している細胞と比べ、大きさが拡張しており、平らな形をしています。老化細胞は広範囲に渡り空胞を形成しており、多核である場合もあります。さらに、ラミンB1の発現がないため、核膜の完全性が失われています。老化細胞は機能不全ミトコンドリアを蓄積し、活性酸素 (ROS) のレベルが増加しています。リソソーム内容物の増加とリソソーム活性の変化も見られ、これはpH 6.0におけるβ-ガラクトシダーゼの活性上昇に反映されます。SA-β-Gal (senescence-associated β-galactosidase) の活性は細胞老化のバイオマーカーとして広く受け入れられています。
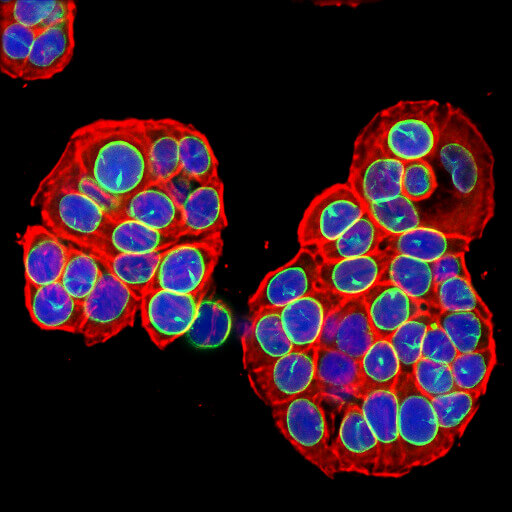
ラミンB1 (ここでは緑で表示) の欠失は、細胞老化のマーカーとして利用されます。
クロマチン再構成と遺伝子発現の変化
老化細胞の特徴の一つに広範囲に渡るクロマチンの再構成が挙げられ、最も顕著なものにSAHF (senescence-associated heterochromatin foci) の形成があります。これらの部位は条件的ヘテロクロマチン領域 (発生段階や細胞の種類によって異なるヘテロクロマチン領域) の一種で、これによって細胞の増殖を促進する遺伝子 (E2F標的遺伝子サイクリンAなど) などがサイレンシングされます。老化細胞には、一般的に30-50のSAHFがみられます。これらはDAPIによる染色 (明るく染色される部位) のほか、macroH2A、HP1 (heterochromatin protein1)、Lys9がジメチル化/トリメチル化されたヒストンH3 (H3K9Me2/3) を抗体で染色することで観察できます。SAHFは老化した細胞で高頻度に見られますが、SAHFを形成せずに老化する細胞もあります。
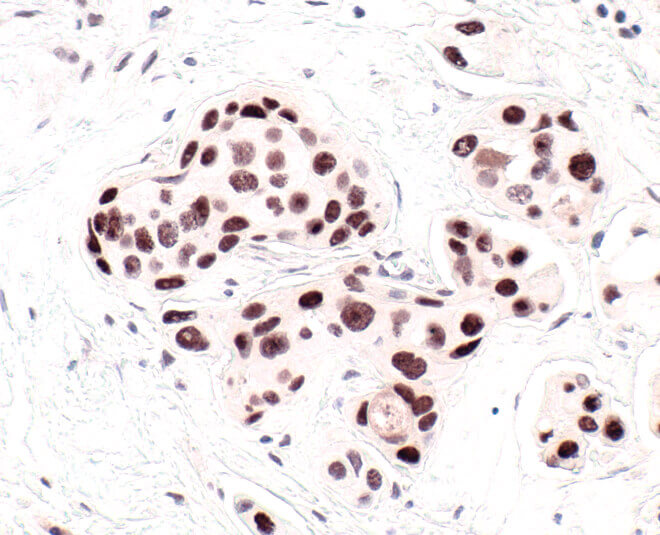
HP1は、最もよく利用される細胞老化のマーカーです。HP1α抗体を用いてパラフィン包埋ヒト乳がん切片のHP1をIHCで可視化しました。
DNAの損傷と持続的なDNA損傷応答 (DDR)
DNA二本鎖断裂などのDNA損傷は、細胞老化で見られる特徴の一つです。老化細胞では持続的なDNA損傷応答 (DDR) がみられ、最終的に細胞周期の停止を誘導します。老化細胞には、DNA-SCARS (DNA Segments with Chromatin Alterations Reinforcing Senescence) と呼ばれる核内構造体がみられます。これはPML核体の関連構造体で、活性化したp53、ATR、ATMなどのDDRタンパク質を蓄積します。キャップ構造のないテロメアでみられるDNA-SCARSは、TIF (Telomere dysfunction-Induced Foci) と呼ばれています。DNA損傷の別の指標に、リン酸化H2A.Xであるγ-H2A.Xがあります。H2A.XはDNAの二本鎖断裂が起こった場合に、チェックポイントを介して細胞周期を停止させ、DNA修復を行うために必要なバリアントヒストンです。電離放射線やUVの照射、放射性類似薬剤でDNA損傷を誘導することで、H2A.XのSer139の急速なリン酸化がみられます。
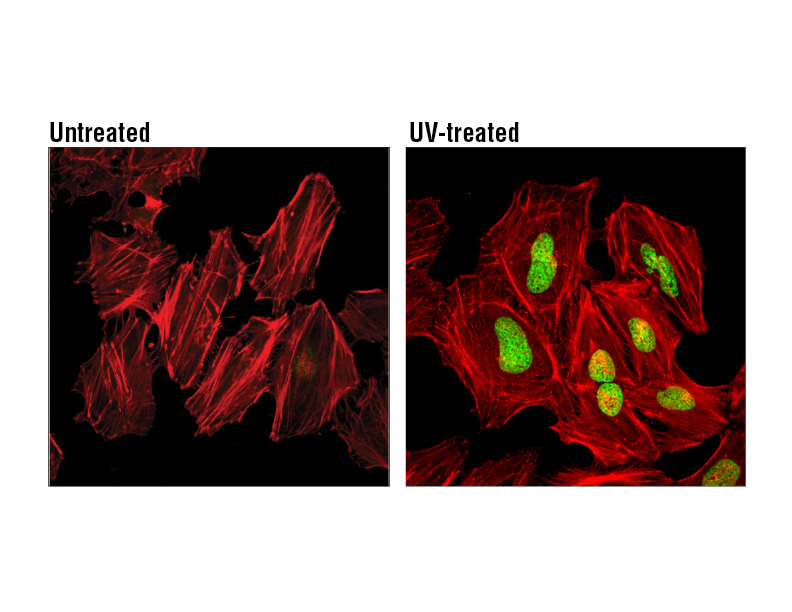
H2A.Xは、よく利用される細胞老化のマーカーです。UV照射 (100 mJ/cm2) したHeLa細胞 (右)、未処理コントロール細胞 (左) をPhospho-Histone H2A.X (Ser139) Mouse mAb で染色 (緑) しました。アクチンフィラメントは、DyLight 554 Phalloidin (赤) で染色しました。
細胞老化随伴分泌現象 (SASP)
老化した細胞の多くがSASP (Senescence-associated secretory phenotype) と呼ばれる炎症促進性の細胞非自律性表現型を獲得し、有益な効果と有害な効果の両方をもたらします。SASPは分泌されたサイトカイン、ケモカイン、増殖因子、プロテアーゼの複雑な混合物から成り、その組成は細胞や組織の状況と、老化を誘導した刺激により大きく異なります。この分泌現象は、老化細胞の近隣にある細胞や免疫系との情報伝達に寄与し、最終的には細胞の運命に影響を与えます。例えば、SASPは免疫細胞を老化細胞に動員して排除するため、この点において腫瘍に抑制的な機能を持ちます。しかし、SASPは血管新生や細胞外マトリクスのリモデリング、上皮間葉転換 (EMT) を促進する分子を分泌し、腫瘍を促進する機能を持つことも分かっています。また、老化細胞が誘導する慢性炎症は全身性の免疫抑制を誘導し、がんなどの疾患の発症に寄与する可能性があります。慢性的炎症は、加齢に関連した組織の損傷や変性を進行させる可能性もあります。
細胞老化を誘導するシグナルは、最終的にp53/p21CIP1とp16INK4A/pRbのがん抑制経路で合流し、これが細胞周期停止を誘導します。
細胞周期の安定的な停止が細胞老化の決定的な特徴であり、テロメア長の短縮、がん遺伝子の活性化、DNA損傷に応答して起こります。細胞周期停止は、p53/p21CIP1またはp16INK4A/Rbがん抑制経路の活性化を介して起こります。興味深いことに、種々のがんで、これらの経路の構成因子の変異がみられます。
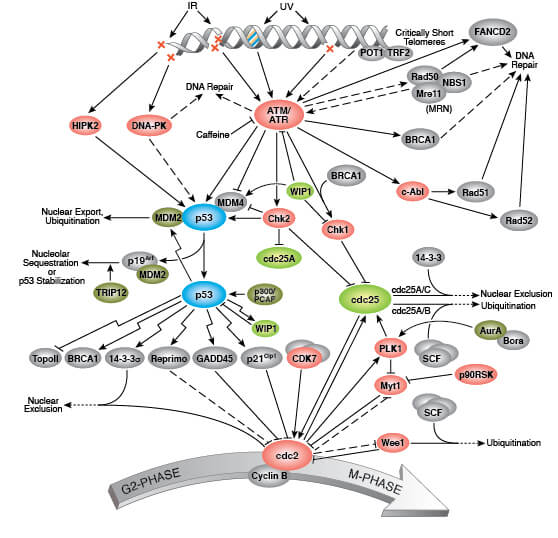
細胞周期G2/M、DNA損傷シグナル伝達経路
慢性的なゲノムストレスやテロメア短縮に誘導される持続的なDNA損傷応答 (DDR) は、がん抑制遺伝子p53の活性化の原因となり、p21CIP1の発現を誘導して細胞周期を停止させます。p53の上流にはChk1をリン酸化するATRキナーゼと、Chk2をリン酸化するATMキナーゼがあり、DDRの一部としてp53を活性化します。p53はp21CIP1の発現を誘導し、これがサイクリン依存性キナーゼ (CDK) を阻害します。これによってG1/Sチェックポイントを介した細胞周期進行の抑制が起こります。さらに、CDKの阻害はがん抑制遺伝子産物Rb (Retinoblastoma) のリン酸化をブロックし、これによってE2Fによる増殖促進遺伝子の転写が抑制されます。p16INK4AもCDK4とCDK6を阻害することでRbのリン酸化を抑制し、E2Fによる標的遺伝子の転写を妨げます。
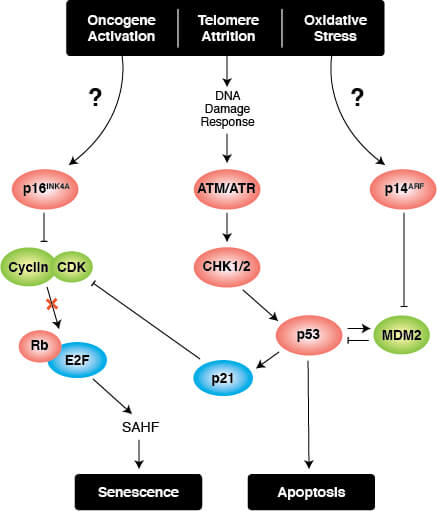
細胞老化の転写調節
Cell Signaling Technologyは、老化細胞を特定するための抗体と検出試薬を取り揃えています。
| タンパク質またはマーカー | 細胞老化における役割 |
|---|---|
| Senescence-associated (SA) β-galactosidase | 老化細胞において、pH 6.0で活性が上昇する |
| p53 | 活性化することで細胞周期の停止が誘導される |
| Rb (Retinoblastomaがん抑制遺伝子産物) | リン酸化を阻害することで細胞周期の停止が誘導される |
| p21CIP1 | p53の下流でサイクリン依存性キナーゼを阻害する |
| p16INK4A | pRbのリン酸化と不活性化を阻害する |
| Bcl-2 | 老化細胞で発現が増加し、アポトーシスを阻害する |
| macroH2A1.1 | macroH2A1アイソフォーム、SAHFのマーカー |
| macroH2A1.2 | macroH2A1アイソフォーム、SAHFのマーカー |
| H3K9Me2/3 (Lysine9がジメチル化またはトリメチル化されたヒストンH3) | SAHFのマーカー |
| HP1 (heterochromatin protein 1) | SAHFのマーカー |
| リン酸化ヒストンH2A.X (Ser139) | DNA損傷のマーカー |
| Lamin B1 | 老化細胞における発現の低下し、核膜崩壊の原因となる |
| HMGB1 (High mobility group protein B1) | SASP構成因子 |
| IL-6 (Interleukin 6) | SASP構成因子 |
| TNF-α (Tumor necrosis factor α) | SASP構成因子 |
| MMP3 (Matrix metalloproteinase-3) | SASP構成因子 |
テロメア長の短縮は、ほとんどの体細胞 (がん細胞と違いテロメラーゼを発現しない) の複製老化を誘導します。
テロメアは染色体末端のヌクレオチド反復配列とそこに結合するタンパク質で構成されています。染色体の分解や染色体末端同士の融合を防ぐためのキャップとしての機能を持ちます。テロメアDNAはGTに富む短い反復配列が数百から数千繰り返されたもので、最末端ではGTに富む単鎖のオーバーハングを形成しています。Shelterinタンパク質複合体は反復配列に結合して、染色体末端のTループと呼ばれるキャップ構造の形成を促進します。Shelterin複合体はTRF1 (telomere repeat factor 1)、TRR2 (telomere repeat factor 2)、TERF2IP (telomeric repeat-binding factor 2-interacting protein、またはRAP1)、POT1 (protection of telomere 1)、TIN2 (TRF1- and TRF2-interacting nuclear protein2)、TPP1 (TIN2 binding protein) によって構成されています。
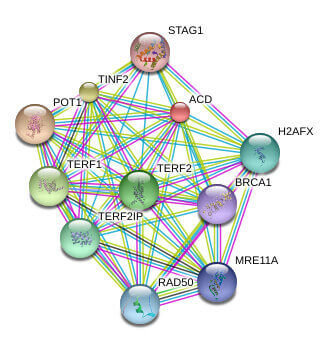
TPP1の既知の、または予測されるタンパク質間相互作用
テロメア配列はDNAポリメラーゼで完全に複製することができず、体細胞の大半でその短縮が進行していきます。がん細胞、幹細胞、生殖細胞は、テロメア末端配列を新たに合成する核酸-タンパク質複合体であるテロメラーゼを発現します。テロメラーゼ複合体はTERT (telomerase reverse transcriptase)、TERC (telomerase RNA)、DKC1 (Dyskerin) によって構成されています。テロメラーゼを発現する細胞ではテロメアの長さが維持されるため、複製老化に達することなく継続的に増殖することができます。
テロメアの安定性や長さを制御する機構の破綻、例えばShelterinやテロメラーゼ複合体を形成するタンパク質の変異などは、ゲノムの不安定性、組織の損傷、がんに深く関わってきます。テロメアを維持する機構の失陥が関与する遺伝病は、まとめてTelomeropathyと呼ばれています。例えば、TERT、TERC、DKC1、またはTINF2をコードする遺伝子の変異は、爪の萎縮、皮膚の色素沈着、および口腔内白斑 (口腔白板症) に特徴づけられる疾患である、先天性角化異常症 (DKC) の原因となります。DKC患者は頻繁に骨髄機能不全を発症し、白血病やその他のがんリスクが高くなります。DKCの重症型であるHoyeraal-Hreidersson症候群は、小脳萎縮や小頭症を引き起こします。テロメア機能不全はまた、特発性肺線維症、家族性肝硬変、自発性急性骨髄性白血病 (AML) にも関与します。
DNA複製が一度行われるたびに、テロメアは50-100塩基づつ短縮され、複製老化に至ります。DNA合成の間、DNAポリメラーゼはラギング鎖の最後のシーケンスを完全に複製することができません。これが「末端複製問題」です。その結果、複製されなかった配列が欠失し、テロメア短縮が進行します。テロメアが臨界長に達すると、テロメアのキャップ構造が崩壊し、細胞にDNA二本鎖の断裂として認識されます。これは持続的にDNA損傷応答を活性化させ、細胞分裂にストップがかかります。がん細胞などのテロメラーゼを発現する細胞は、テロメアの長さを維持し細胞老化による増殖停止を回避することができます。
老化細胞は加齢とともに蓄積し、正常な加齢の過程と加齢に伴う疾患に寄与します。がん、神経変性疾患、代謝疾患、循環器疾患など、老化、加齢、加齢に伴う病態を解明する上で、細胞老化の研究が進められてきました。齧歯類モデルでの研究によると、in vivoで老化細胞を選択的に排除すると、炎症の低減、免疫機能の向上が起こり、これに伴って加齢に伴う疾患の進行が緩められ、健康や寿命が改善します。例えば、一部の化学療法薬など老化を誘発する薬剤は、がん細胞の複製を抑制することで治療効果が得られると考えられます。しかし、このような化学治療を施した患者では、老化細胞が蓄積し、これが疲労などの望ましくない副作用をもたらすことが予想されます。さらに、老化細胞はSASP構成因子の放出を通じてがんの再発と転移にも寄与します。したがって、化学治療中の患者に老化細胞を標的とする治療薬Senolyticsを併用することで、がん再発を回避し副作用が緩和される可能性があります。Senolytics療法は、正常マウスの寿命を延ばし加齢関連の肉体的な衰えを遅らせることもできるので、加齢に伴う疾患の治療に有効である可能性があります。現在Senolytic薬は、変形性関節症と慢性腎臓病の治療に対するヒトを対象とした臨床試験中です。
早老症候群として知られる早期老化に類似した症状を示す疾患の研究から、加齢におけるゲノムの完全性とDNA損傷の意義が解明されつつあります。ヒトが発症するこのような疾患にはウェルナー症候群、ハッチンソン・ギルフォード・プロジェリア症候群、そして色素性乾皮症などがあります。早老症候群のマウスモデルを使って、早期老化と細胞老化のメカニズムの研究が行われています。例えば、細胞周期チェックポイントキナーゼであるBubR1の発現量が少ないマウスは加齢が速く、加齢に伴う病態がみられる組織でp16INK4Aの高発現がみられます。生殖系列でのp16INK4Aの欠失は、BubR1低発現マウスの早期老化を遅延させ、生物学上の加齢と細胞の老化のin vivo相関性が示されました。さらに、p16INK4Aを発現する老化細胞を選択的に排除できるマウスモデル(INK-ATTAC) の研究から、老化細胞の除去がマウスの寿命と健康寿命を延ばすことが示されました。
老化促進マウス (SAM) モデルの系統がいくつか開発されています。この系統は、老化の特徴と表現型が一致する (活動の低下、脱毛、寿命の短縮など) マウスに由来します。SAMマウスは学習障害や記憶障害、骨粗しょう症、リンパ腫などの病理学的作用の表現型を示します。
その一方で、加齢と老化の遅延を研究するために動物モデルも使われています。例えば、ハダカデバネズミは小さいマウスと同じ大きさの齧歯類で、30年かそれ以上生きる、その大きさと対比して寿命の長い動物です。ハダカデバネズミががんを発症することはまれで、高齢になっても健康で活発です。興味深いことに、この動物に老化は普通に起こり、寿命の長さは細胞老化反応の排除に依存しないことを示唆しています。

ハダカデバネズミ
帰属:
Roman Klementschitz、ウィーン [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)]、Wikimedia Commonsより
細胞老化と加齢のメカニズムを解明することで、加齢に伴う病態や疾患の治療法の開発につながる可能性があります。糖尿病治療に認証されているメトホルミンは、インスリンを減少させ、IGF-1シグナル伝達を抑制し、AMPKの活性化とmTOR (mechanistic target of rapamycin) の阻害が起こります。メトホルミンはSASPを阻害し、ヒトのがん発生率を低下させる可能性があります。「Targeting Aging with Metformin (TAME)」という臨床試験で、メトホルミンによる治療が、がんや心臓病、認知症などの加齢に伴う病気を遅らせるか、発症を回避させることができるかどうかが評価されます。