View in English?
View in English?

ショウジョウバエ由来Amphiphysin BARドメイン
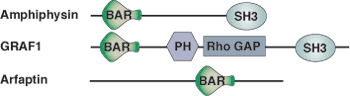
BAR (Bin/Amphiphysin/Rvs) ドメインは、ヒトゲノムにコードされた35種類以上のタンパク質で見出されています。これらのタンパク質は、エンドサイトーシス (Endophilin、Sorting Nexin、Amphiphysin) やアクチンの再構築 (RhoGAP、RhoGEF) など、多様な細胞プロセスで機能しています。ArfaptinのBARドメインはRac1に結合することが示されています。機能的なBARドメインの二量体は、バナナの形をした6本のヘリックスの束で、先端および凹面側の表面に沿って正電荷を持ち、これがリン脂質との結合を媒介すると考えられています。この凹面の曲率が、約220オングストロームの直径を持つ円形の膜にぴったり合うことになります。すべてのBARドメインが湾曲した脂質に結合すると考えられていますが、BARドメインの一部は、膜の湾曲を誘導することができます。したがって、BARドメインは小胞形成の過程において、標的タンパク質が湾曲した膜に移行する、もしくは膜の湾曲の誘導を物理的に助けるところで機能することが予測されています。
AmphiphysinのBARドメインは、およそ210アミノ酸残基の長さを持ち、3本の突出したαヘリックスから成るコイルドコイル構造で構成されています。2つの単量体が二量体を形成して、6本のヘリックスを持つバナナの形をした機能的な束になります。正電荷はバナナ様構造の先端および凹面の表面に沿って集積されます。これらの正電荷は、湾曲した凹面の表面が直径約220オングストロームの円形の膜にフィットする、リン脂質への結合を媒介すると考えられています。