View in English?
View in English?
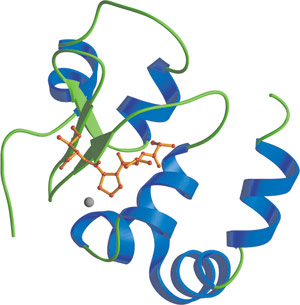
亜鉛原子との結合を示した、XIAPの3番目のBIRドメイン 。Smac N末端残基 (赤) との結合と、亜鉛原子を示しました。
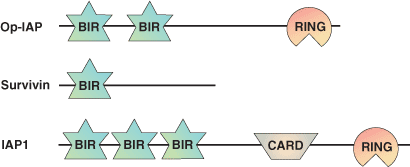
BIR (Baculovirus IAP Repeat) ドメインは、およそ70のアミノ酸からなる亜鉛結合領域で、IAP (Inhibitors of Apoptosis) ファミリータンパク質間にみられる相同的な配列から同定されました。BIRドメインは真核生物の80種類以上の異なるタンパク質で同定されており、タンパク質あたり1から3コピーが直列に並んでいます。BIRドメインは、IAPタンパク質の生物学的な機能に深く関わることが知られています。IAPは、細胞内でアポトーシスシグナルを伝達するシステインプロテアーゼの一群であるカスパーゼに結合し、これを阻害します。BIRドメインは、無脊椎動物の細胞死誘導因子 (ショウジョウバエのReaper、Grim、HID、Doomなど) や、脊椎動物、無脊椎動物のカスパーぜといった、アポトーシス促進因子と、IAPタンパク質との相互作用に必要です。Caspase-9の阻害においては、XIAPの3番目のBIRドメインが、ATRF/AVPYのN末端モチーフと相互作用します。このモチーフは、Procaspase-9の切断によって生じる、Caspase-9のp12小サブユニット上のリンカーペプチド上にみられます。Smac/Diabloタンパク質は、BIR3に高い親和性をもつペプチドを提示して、XIAPとCaspase-9の結合を阻害、隔離します。XIAPの2番目のBIRドメインは、カスパーゼ結合の調節因子として作用して抗アポトーシス効果を発揮しますが、一方でN末端のリンカーはCaspase-3およびCaspase-7の基質結合部位の溝と相互作用して活性を阻害します。このリンカーペプチドは、カスパーゼの活性部位にまたいで存在し、そこで基質結合を阻害します。この第2のBIRドメインを欠失させるとXIAPの抗アポトーシス作用が消失します。これはこのBIRドメインの除去により、このタンパク質がカスパーゼの結合に影響を及ぼすような立体構造を取ることができなくなるためです。また、BIRドメインは、同種親和性相互作用を媒介することもできると考えられています。
| BIRドメインタンパク質 | 結合パートナー |
| Survivin | 同種間の相互作用を介したSurvivin |
| Op | HID, Grim, Reaper |
| D-AIP1 | HID, Grim |
| D-AIP2 | Reaper |