View in English?
View in English?
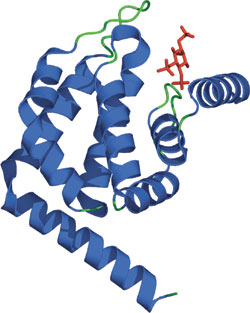
PtdIns(1,4,5)P3に結合したEpsinのENTHドメイン
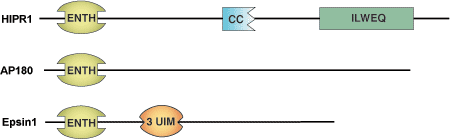
ENTH (Epsin NH2-Terminal Homology) ドメインは、およそ150アミノ酸残基からなる膜結合モチーフで、エンドサイトーシスタンパク質Epsin 1で最初に同定されました。このドメインを持つタンパク質は、PtdIns(4,5)P2 (ホスファチジルイノシトール-4、5-ビスリン酸) およびPtdIns(1,4,5)P3 (ホスファチジルイノシトール-1、4、5-トリスリン酸) を含むリン脂質に結合することができます。このため、エンドサイトーシスにおいて、ENTHドメインがリン脂質2重層に結合することで、ENTHドメインをもつタンパク質はClathrinアダプターとして機能し、Clathrinの構成成分やアクセサリー因子が膜にリクルートされるようになると考えることができます。一対のENTHをもつタンパク質 (HIP1、HIP1R) は、Clathrin被覆ピットに局在し、またアクチン結合モチーフ (ILWEQ) を持つことから、アクチン細胞骨格とエンドサイトーシスを共役させている可能性があります。
一次配列上の相同性は高くありませんが、構造解析された様々なENTHドメインは大変良く似ていて、さまざまな長さを持つループでつながった8本のαヘリックスで構成されます。3本のらせん状のヘアピン (α1-2、α3-4、α6-7) が、右向きにねじれながら連続して積み重なっており、ENTHドメインに対して直角に配置されています。正電荷をもつアミノ酸残基の裂け目は、リン脂質の結合の一因となっています。すべてではありませんが、一部のENTHファミリーメンバー (AP180/CALM) に存在する塩基性アミノ酸残基のクラスターは、ホスホイノシチドに対する親和性を高めることが示されています。
| ENTHドメインタンパク質 | 結合パートナー |
| Epsin1 | PtdIns(4,5)P2 / PtdIns(1,4,5)P3 |
| AP180 | PtdIns(4,5)P2 / PtdIns(1,4,5)P3 |
| HIP1R | PI(3,4)P2; PI(3,5)P2 |