View in English?
View in English?
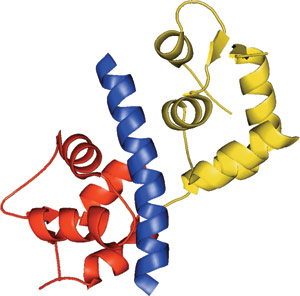
Mlc1p N-lobe (赤) およびC-lobe (黄) へ結合したMyo2pのIQモチーフ
IQドメインはおよそ25アミノ酸残基から成り、自然界に広く分布しています。このモチーフは、コンセンサス配列 [I,L,V]QxxxRGxxx[R,K] に従い、Ca2+非依存的にCalmodulinと結合することができる両親媒性の7回ターンのαヘリックスを形成します。IQモチーフは、密集、あるいは拡張した軽鎖の立体配座をとります。Calmodulinは、主要な細胞内2次シグナルであるCa2+の効果を媒介し、ミオシン等のタンパク質を介したアクチン細胞骨格の変化を惹起することができます。ほぼすべてのミオシンタンパク質が、1から7つまでのIQドメインを持ち、そのほとんどが、9-16アミノ酸残基によって隔てられた複数の直列反復配列の中にみられます。様々な組合せのタンパク質由来のIQモチーフによるCalmodulinの結合により、Ca2+のシグナル伝達が広範な細胞活性に影響を及ぼすことを可能にすると考えられています。少なくとも1つのIQドメインを含むタンパク質には、ミオシン、電位作動性チャネル、神経成長タンパク質、ホスファターゼ、精子の表面タンパク質、Ras交換タンパク質、紡錘体会合タンパク質、少なくとも1つのRasGAP様タンパク質、ならびに幾つかの植物に特異的なタンパク質があります。
IQドメインは、明確に両親媒性の、連続した7回ターンのαヘリックスを形成します。このヘリックスの非極性の面は、5回目のターンの後で向きが入れ替わり、リガンドが接触するための新たな表面を作ります。Calmodulinとの相互作用に重要なアミノ酸残基は、1位の疎水性アミノ酸、2位の高度に保存されたグルタミン、6位と11位の塩基性電荷、そして7位の可変グリシンです。この7位のグリシンを、およそ50%のIQドメインで見られるような、巨大側鎖を持つアミノ酸残基と置換すると、Calmodulinの相互作用にいくらかの特異性を与えると考えられます。IQコンセンサス配列中に介在する6つのアミノ酸の独自性が、カルモジュリン特異性に関与していると思われます。
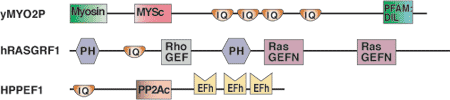
| IQドメインタンパク質 | 結合パートナー |
| Myo2p (クラスVミオシン) | Mlc1p (calmodulin-like myosin light chain)、Ca2+-非依存型 |
| Neurogranin | CaM (Calmodulin)、Ca2+非依存型、IQモチーフのPKCリン酸化によって調節される |
| Ras-GRF (交換因子) | IQドメインへのCaM (Calmodulin)、Ca2+-誘導性結合 |