View in English?
View in English?
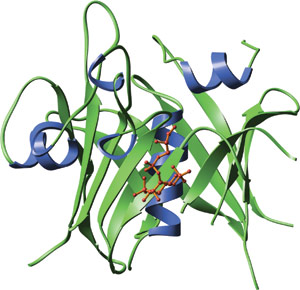
PI(4,5)P2の頭部グループの類似体である、GPMI-p2 (赤) に結合した、マウスTubbyのカルボキシ末端ドメイン
TUBBYドメインは最初、成人発症肥満と関係があるとされるTUBBYタンパク質において同定されました。TUBBYドメインは、約260アミノ酸残基の長さに及ぶため、2つの結合性を持ち、DNAとホスファチジルイノシトールの両者と相互作用します。TUBBYおよびTULPタンパク質のTUBBYドメインは、イノシトール環の4位がリン酸化されたホスホイノシチド二リン酸 (例えばPI(4,5)P2など) に高い特異性をもって結合します。これによって、TUBBYドメインは5HT2Cセロトニン受容体などの、受容体の下流に向けて機能するようになります。5HT2Cの活性化は、Phospholipase C (PLC) を活性化する三量体Gタンパク質の刺激につながります。PLCによるPI(4,5)P2 の加水分解は、TUBBYドメインを膜から遊離し、核移行を可能にします。核内に入ると、TUBBYドメインはDNAに結合し、TUBBYタンパク質N末端の転写因子様活性化ドメインが転写を促進します。
TUBBYドメインは、ヘリックスで埋まった特殊なβ樽状構造を形成します。ホスファチジルイノシトール-4,5-ビスリン酸の頭部のアナログ (4,5) の1つ、GPMI-P2と複合体を作ったTUBBYドメインの共結晶構造解析により、ホスホイノシチドの結合が、DNA結合が推定される溝の一端にある塩基性ポケットの中で起こることが明らかとなっています。GMPI-P2との相互作用に関与するアミノ酸側鎖は、主に、βストランド4、5および6と、ヘリックス6Aにあります。結合面における中心となるのはLysine-330で、これが4位と5位のリン酸基を調整し、そしてイノシトール環に隣接する位置でリン酸化されたホスファチジルイノシトールに対する高い選択性を与えています。
| TUBBYドメインタンパク質 | 結合パートナー |
| Tubby | PI(4,5)P2; PI(3,4)P2 |