View in English?
View in English?
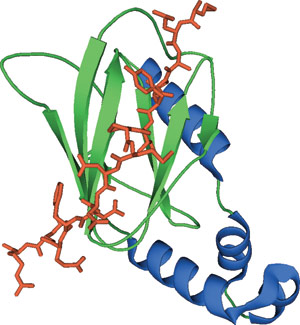
HIFαのヒドロキシプロリンペプチドに結合したVHLドメイン
VHLは、ElonginC、ElonginB、Cul2、Rbx1とともにE3ユビキチン-タンパク質リガーゼ複合体を形成し、VHLはこの複合体の基質認識サブユニットとして機能します。VHLのβドメインは、およそ100アミノ酸残基から成り、標的タンパク質内のヒドロキシル化プロリンと相互作用することが示されています。VHLのβドメインにある接触アミノ酸残基は、ヒト、ハエ、カエル、蠕虫のVHLオルソログで良く保存されています。このE3複合体に新式された基質はポリユビキチン化され、プロテアソーム分解の標的にされます。VHLのβドメインは、HIF-1αおよびRNAポリメラーゼIIの大型サブユニットの特異的なヒドロキシル化プロリンと相互作用することが示されています。VHLのβドメインはまた、いくつかの非定型PKCアイソタイプと相互作用することが示されています。
VHL (von Hippel-Lindau tumor suppressor protein) のβドメインは、N末端の7本鎖から成るβサンドイッチと、疎水的相互作用を介してβストランド1本に折り畳まれたC末端のαヘリックスから構成されます。このβサンドイッチは、部分的に露出した疎水性コアを形成し、他の極性残基と共に、ヒドロキシプロリンペプチド含有リガンドに対する結合部位となります。この相互作用は、VHLのTrp88、Tyr98、Trp117とピロリジン環との間の複数のファンデルワールス接触、および、His115とヒドロキシプロリンの4-ヒドロキシル基との間の水素結合によって媒介されます。

| VHLドメインタンパク質 | 結合パートナー |
| Hrs | Hrs FYVEドメイン |