View in English?
View in English?
高い特異性をもつことが優れた抗体の最も重要な条件ですが、研究サンプルが限られている場合や、発現量の低いタンパク質を解析する場合には、感度が重要になることもあります。ここでは、Phospho-GSK-3β (Ser9) (D85E12) XP® Rabbit mAb #5558とPhospho-S6 Ribosomal Protein (Ser235/236) (D57.2.2E) XP® Rabbit mAb #4858について、ウェスタンブロットで他社製品との比較を行いました。また、#4858については、その他のCSTラビットモノクローナル抗体である#4856および#4857との比較も行いました。
| CST #5558 | 他社製品 1 | 他社製品 2 | |
|---|---|---|---|
| ウェスタンブロットの希釈率 | 1:1000 | 1:200 | 1:500、1:250 |
| アッセイ濃度 (µg/mL) | 0.29 | 0.5 | 1 |
| 推奨アプリケーション | W, IP, IF-IC, F | W, IP | W, IF-IC, F |
| 動物種交差性 | H, M, R, Hm | H, M | H |
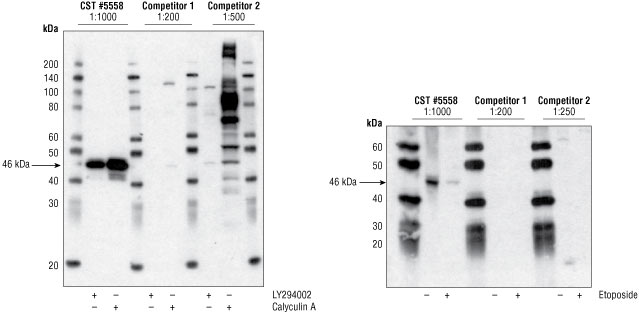
図 1 LY294002 #9901処理 (GSK-3βのリン酸化を阻害するPI3キナーゼを阻害する)、またはCalyculin A #9902処理 (細胞抽出物中に存在するホスファターゼを阻害することでリン酸化レベルを人工的に増加させる) で、GSK-3βのリン酸化を誘導したJurkat細胞サンプルをウェスタンブロットで解析しました (左図)。いずれの抗体を用いた場合でも、Calyculin A処理したサンプルで、適切な分子量 (46 kDa) のシグナルが検出されましたが、#5558を用いた場合に最も強く検出されました。注意:他社製品2を用いた場合では、適切な46 kDaのバンドよりも強く検出される非特異的なバンドが多くみられました。一方、Etoposide処理 (アポトーシスの誘導試薬で、GSK-3βのリン酸化レベルを低下させることが知られている) したJurkat細胞サンプルと、未処理のサンプルをウェスタンブロットで解析した場合 (右図) 、他社製品のどちらを用いた場合でも、Etoposide処理の有無に関わらず、リン酸化GSK-3βは検出されませんでした。
| CST #4858 | 他社製品 1 | |
|---|---|---|
| ウェスタンブロットの希釈率 | 1:2000 | 1:1000 |
| アッセイ濃度 (µg/mL) | 0.029 | 不明 |
| 推奨アプリケーション | W, IHC-P, IHC-F, IF-IC, F | W |
| 動物種交差性 | H, M, R, Mk, Sc, (C) | H, (R) |
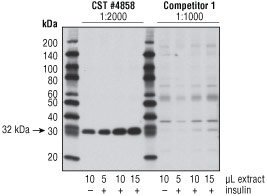
図 2 インスリン処理 (100nM、10分間) したNIH/3T3細胞抽出物を段階希釈したサンプル、インスリン未処理サンプルを調製し、ウェスタンブロットで、#4858 (CST推奨濃度、2000倍希釈で使用) と、他社製品 (メーカー推奨範囲の最低希釈率、1000倍希釈で使用) を比較しました。#4858を用いた場合は、より強いシグナルが検出され、一方、他社製品を用いた場合は、未処理サンプルやインスリン処理サンプルを最少量ロードしたレーンでは特異的なシグナルがほとんど検出されませんでした。注意:他社抗体を用いた場合は、適切な分子量のバンドより強く検出される、交差反応によるバンドがみられ、特異性に欠けることが分かります。
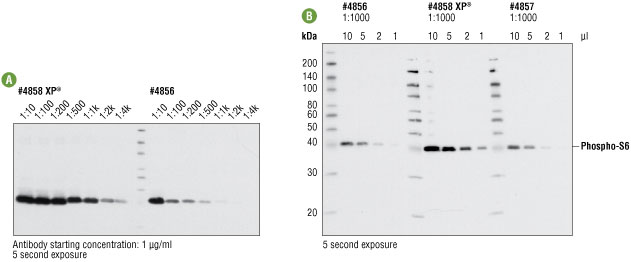
図3A #4858、#4856の希釈系列 (最高濃度1 μg/mL) を用い、インスリン処理したHeLa細胞抽出物をウェスタンブロットで解析しました。どちらの抗体でも、明瞭な特異的シグナルが得られましたが、#4858でより強いシグナルがみられました。1 ng/mLで用いた場合を比べると、#4858では5秒の露光時間で強いシグナルが得られるのに対し、#4856で得られるシグナルは、それよりはるかに弱いことが分かります。
図3B CSTの#4858、#4856、#4857を1000倍希釈で用い、インスリン処理 (100 nM、10分間) したHeLa細胞抽出物の希釈系列をウェスタンブロットで解析しました。この場合も、#4858で最も強いシグナルが得られました。
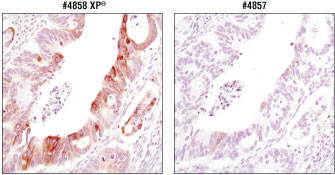
図 4 同一濃度 (80 ng/mL) の#4858、#4857を用いて、パラフィン包埋結腸がん検体を、免疫組織化学染色で解析しました。どちらの抗体でも特異的な染色像が得られましたが、#4858を用いた場合に、より強い染色がみられました。
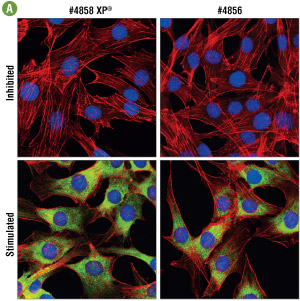
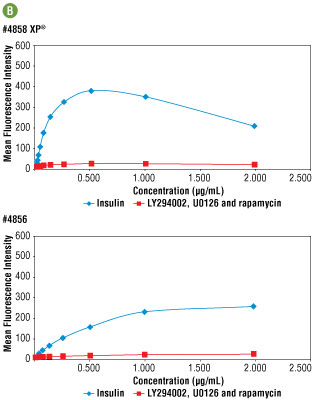
図5A LY294002 #9901、U0126 #9903、Rapamycinで2時間の処理したC6細胞 (上段) 、およびインスリン処理 (100 nM、30分間) したC6細胞 (下段) を、#4858 (左) または#4856 (右) で免疫蛍光染色し、共焦点顕微鏡で観察しました。アクチンフィラメントをAlexa Fluor® 555 phalloidin (赤)、DRAQ5 #4084 (蛍光DNA色素) は、青の疑似カラーで示しています。最適濃度 (0.25 μg/mL) で#4858を用いた場合に、より強い染色がみられました。最適濃度の設定については、図5Bをご確認ください。
図5B #4858と#4856の力価を免疫蛍光染色で測定、比較し、両者の最適濃度をともに、0.25 μg/mLと決定しました。この濃度において、#4858で得られる輝度は2倍高く、より高感度に機能することが分かります。
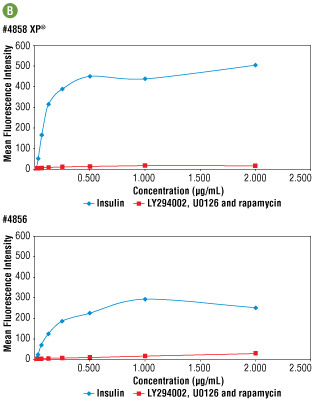
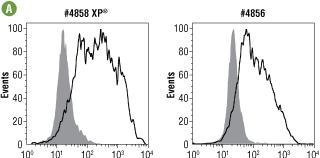
図6A 最適濃度 (それぞれ0.25、0.5 μg/mL) の#4858 (左) と #4856 (右) を用い、LY294002 #9901、Wortmannin #9951、U0126 #9903で処理したJurkat細胞 (白抜き) と未処理のコントロール細胞 (グレーの網掛け) を、フローサイトメトリーで解析しました。
図 6B #4858と#4856の力価を免疫蛍光染色で測定、比較し、#4858と#4856の最適濃度をそれぞれ0.25、0.5 μg/mLと決定しました。この濃度において、#4858で得られる輝度は、約2倍高く、また、未処理コントロールと比較した場合も約2倍の輝度が得られました (not shown)。これらの結果から、フローサイトメトリーで用いた場合にも、#4858はより高感度に機能することが分かります。