View in English?
View in English?
iPRMは、質量分析の特異性、免疫アッセイのスループット、そしてマルチプレックスのパワーを組み合わせて薬剤や診断検査の市場投入までの時間を短縮する、マルチプレックスLC/MSアッセイサービスです。弊社のiPRMサービスは、CSTの科学者のプロテオミクスに関する知識と、CSTの抗体の確立された特異性と感度を活用することによって、アッセイ開発を合理化し治療薬を確実に検証することができます。iPRMサービスでは次のことが可能です。
iPRMサービスについてCSTの専門家にお問い合わせください。詳細はこちら。
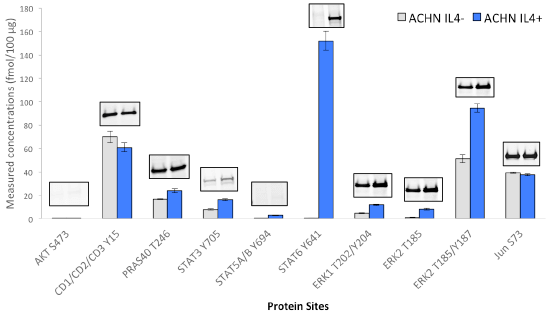
Interleukin-4 (IL-4) 摂動下のヒト腎がん細胞株ACHNにおけるリン酸化標的のiPRMアッセイデータと対応するウェスタンブロッティングの結果。細胞は採取前にHuman Interleukin-4 (hIL-4) #8919 40 ng/mlで20分間処理しました。iPRMアッセイでは、ACHN細胞のタンパク質をトリプシンで消化し、その100 µgを内部標準として機能する重同位体標識ペプチドと混合しました。以下のCST抗体5 µgを用いてマルチプレックス免疫沈降を実施しました。AKT S473 (#4060), CDK1/2/3 Y15 (#4539), PRAS40 T246 (#2997), STAT3 Y705(#9145), STAT5A/B Y694 (#9314), STAT6 Y641 (#9364), ERK1 T202/Y204(#4370), ERK2 T185(#4370), ERK2 T185 (#4370), Jun S73(#3270). 免疫濃縮後、ペプチドをQ Exactive™質量分析計によりマルチプレックスPRM解析しました。次に、Skylineでピーク範囲を抽出し、ペプチドの軽重比に基づいてペプチド濃度を計算しました。免疫捕捉とPRM解析は3連で実施しました。iPRMアッセイに使用したのと同じ抗体をウェスタンブロッティングにも適用しました。コントロールおよび処理済みACHN細胞のタンパク質抽出物20 µgを、各ブロットで4% - 20%のSDS-PAGE勾配ゲルにロードしました。ニトロセルロース転写膜に転写した後、タンパク質をリン酸化特異的抗体により希釈率1:1000で検出しました。
コア針生検、細胞、組織など様々な研究、臨床、前臨床サンプルからのライセートはタンパク質消化され、アッセイの標的は、それと化学的に同一の定量された重同位体ペプチド標準物質と共に抗体濃縮されます。濃縮されたサンプルは、Thermo Scientific™ Q Exactive™ Hybrid Quadrupole-Orbitrap™質量分析計 (MS) でPRMスキャン標的化により解析し、標的と標準ペプチドを最高の感度で正確に定量化します。データはMicrosoft® Excel®とPowerPoint®で表示しています。
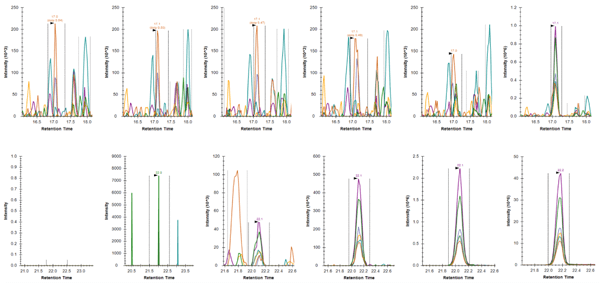
Jun (S73) のPRM (上列) およびiPRM (下列) による解析後の様々な濃度のリン酸化ペプチドLAS*PELER++のSkylineにより抽出されたピークの比較。フラグメントイオンのピーク (y7-98+、y6-98+、y5+、y3+、y7-98++、y6-98++) を、トリプシン消化SKBR3ライセート1 µgの直接の注入 (上列:PRM) あるいはSKBR3ペプチド100 µgの免疫濃縮後の注入 (下列:iPRM) から質量許容差0.05 m/zで抽出しました。SKBR3細胞ライセートのペプチド濃度は左から右に0、0.2、2、20、200、2000 amol/µgです。ペプチドの下限検出限界 (LLOD) は、PRM法を用いた2000 amol/µgから、iPRMワークフローを用いた2 amol/µgまで低下しました。
以下のすぐに使えるアッセイの一覧から選んでください。これらのアッセイは事前に検証されており、高親和性抗体や社内で合成したAQUAペプチド標準物質など、CST製品を使用しています。
| 製品番号 | タンパク質と部位 | ペプチド | LLOD (fmol/100 μg) | LLOQ (fmol/100 μg) |
|---|---|---|---|---|
| 4060 | Akt S473 | RPHFPQFS*YSASGTA | 0.059 | 0.117 |
| 4539 | CDK1/CDK2/CDK3 Y15 | IGEGTY*GVVYK | 0.015 | 0.046 |
| 2997 | PRAS40 T246 | LNT*SDFQK | 0.004 | 0.012 |
| 9145 | STAT3 Y705 | YCRPESQEHPEADPGSAAPY*LK | 0.124 | 0.373 |
| 9314 | STAT5A/B Y694 | AVDGY*VKPQIK | 0.033 | 0.100 |
| 9364 | STAT6 Y641 | GY*VPATIK | 0.018 | 0.055 |
| 4370 | ERK1 T202/Y204 | IADPEHDHTGFLT*EY*VATR | 0.047 | 0.142 |
| 4370 | ERK2 T185 | VADPDHDHTGFLT*EYVATR | 0.254 | 0.763 |
| 4370 | ERK2 T185/Y187 | VADPDHDHTGFLT*EY*VATR | 0.033 | 0.098 |
| 3270 | Jun S73 | LAS*PELER | 0.021 | 0.063 |
LLODとLLOQは、ブランク上限、ブランクサンプルの分散、および最低レベルのスパイクインサンプルの分散から決定しました。
ご希望のアッセイが見つからない場合は弊社で開発します。CSTのプロテオミクス専門家がお客様と協力して、カスタムアッセイを明示します。その後、CSTは社内でアッセイを開発し検証します。弊社が現在提供していない標的にご興味がおありでしたら、CST抗体のよく知られた特異性と感度を備えたカスタム抗体をお客様と共に開発します。CST以外の開発による抗体もお使いいただけます。
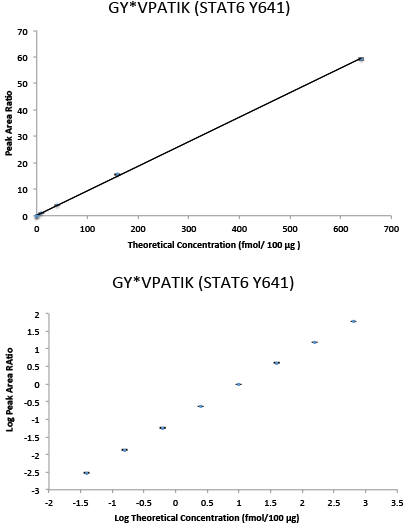
リン酸化STAT6 (Y641) ペプチドGY*VPATIKの直線 (上) と対数空間 (下) におけるiPRM反応曲線。10種類の重同位体標識合成ペプチドの量を増やしながら、内部標準として軽ペプチドをスパイクインした乳がん細胞株SKBR-3由来のトリプシンペプチド100 µgのバックグラウンドにおいて、マルチポイントでの免疫沈降を実施しました。免疫沈降後、ペプチドをQ Exactive™質量分析計で解析しました。ペプチドの量は、Skylineにてフラグメントペプチドの範囲を抽出することで決定しました。各ペプチドの多量にあるフラグメントイオンの3から6までのピーク面積 (重/軽) の比率を計算することによって定量化しました。10種類の標的のマルチプレックスPRMアッセイを実施しましたが、この図は1つのリン酸化ペプチドの代表的なデータを示しています。エラーバーは、3つの捕捉と2連のPRMについてピーク面積比の最小値と最大値を示しています。反応曲線は、リン酸化ペプチドGY*VPATIKの4桁以上の線形範囲と0.039 fmol/100 µgのLLOQを示しています。
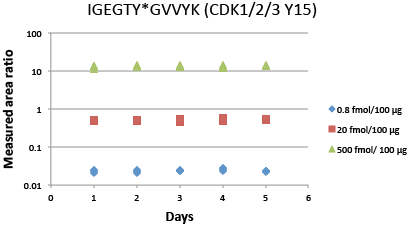
CDK1/2/3 (Y15) のリン酸化ペプチドIGEGTY*GVVYKのiPRMでの5日間の再現性データ。サンプルは、10種類の重同位体標識ペプチドを、内部標準として軽ペプチドをスパイクインした乳がん細胞株SKBR-3由来のトリプシンペプチド100 µgのバックグラウンドにおいて、3つのレベル (高:500 fmol、中:20 fmol、低:0.8 fmol) でスパイクインして調製しました。3連での濃縮は、再現性を測定するため、5日の異なる日にそれぞれ別々に実施しました。免疫沈降後、ペプチドをQ Exactive™質量分析計で解析しました。各ペプチドの多量にあるフラグメントイオンの3から6までのピーク面積をSkylineで抽出し、ピーク面積の比率を軽ペプチドと重ペプチドの合計に基づき計算しました。各ペプチドの異なる開始濃度について、アッセイ内およびアッセイ間の平均CVを測定しました。合計CVは、アッセイ内CVおよびアッセイ間CVの平方和の平方根です。図に示したリン酸化ペプチドIGEGTY*GVVYKでは、すべてのCVが10%内でした。10種類の標的マルチプレックスiPRMアッセイのその他のペプチドでは、すべてのCVが20%内でした。
| アッセイ内平均CV (同日) | アッセイ間平均CV (別日) | 合計CV √(intraCV²+interCV²) | 試験数 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 低 | 中 | 高 | 低 | 中 | 高 | 低 | 中 | 高 | 低 | 中 | 高 |
| 6.0% | 5.2% | 7.5% | 7% | 7% | 5% | 9% | 9% | 9% | 15 | 15 | 15 |