View in English?
View in English?
Small Ubiquitin-like Modifier (SUMO) タンパク質は、タンパク質を可逆的に修飾する低分子タンパク質で、標的タンパク質のリジン残基に共有結合を形成して結合します。タンパク質のSUMO化は、以下のような多くの細胞プロセスにおいて重要な役割を担っています。
PTMScan® Sumoylation Remnant Motif技術では、WaLPで消化したサンプルからCST独自の抗体でSUMO化ペプチドを濃縮します。スレオニン、バリン、アラニン、セリンに対して特異的でユニークなプロテアーゼであるWaLPは、SUMOのC末端のジグリシン (GG) を基質側に残して切断し、SUMO化基質のリジン残基に「タグ」のようにジグリシンレムナント (K-ε-GG) を生成します。その後、得られたK-ε-GG含有ペプチドは、ユビキチンプロファイリングと同様の方法で同定することができます (UbiScan®技術) (図1)。それ故、同じサンプルをWaLP消化するかトリプシン消化するかの違いで、SUMOとユビキチンの両方のプロファイリングに用いることができます。
PTMScan® Sumoylation Remnant Motif技術により同定されたK-ε-GG部位が、ユビキチン化タンパク質由来ではなくSUMO化タンパク質由来であることを確認するため、特異的な脱SUMO化酵素 (SENP 1およびSENP 2) を用いて特異性を検証しました (図2)。この結果から、ユビキチン化ペプチドが、SUMO化サンプルに混入していないことが確認できました。
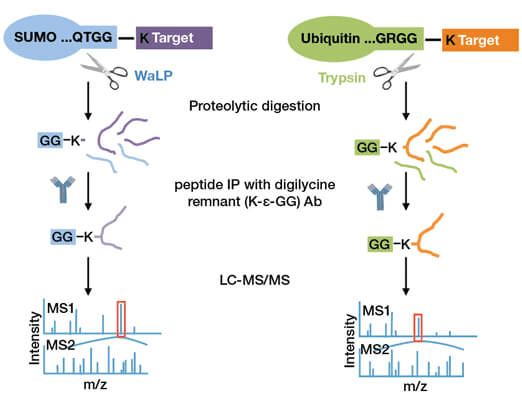
K-ε-GGレムナントモチーフ抗体を使用した、SUMO化ペプチドの濃縮 (左) と、ユビキチン化ペプチドの濃縮 (右) 手法の図解。
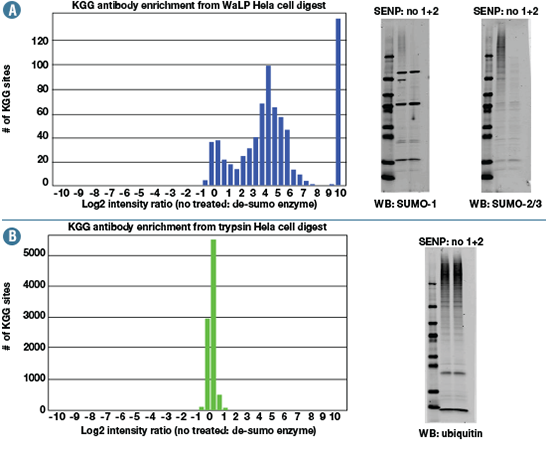
SENP1および2で処理したSUMO化タンパク質由来 (A) とユビキチン化タンパク質由来 (B) のK-ε-GGペプチドの定量結果。SUMO化ペプチドはSENP処理によって減少しましたが、一方でユビキチン化ペプチドでは変化しませんでした。また、この結果はウェスタンブロッティングのデータと一致していました。