View in English?
View in English?
バイナリーアプローチは抗体特異性を評価するのにより適した方法の1つですが、バイナリーモデルは常に容易に利用できる訳ではなく、抗体の検証のみを目的とする場合には時間や費用がかかり過ぎることもあります。さらに、使用する予定のアプリケーションやプロトコールにおける抗体の感度を評価するには、相補的な保証が必要となります。
この目的に理想的なのは、目的の標的を高度、中程度、低度に発現する内因性モデルと異種モデルの両方を含むレンジ戦略です。抗体の最適な使用条件を明らかにするためにレンジアプローチは重要ですが、抗体検証プロセス全体におけるレンジアプローチの重要性は見逃されがちです。
レンジ戦略とバイナリー戦略の最も重要な (しかも微妙な) 違いは、レンジモデルが白黒はっきりしない標的の発現や修飾の差に依存しているという点です。一般にレンジモデルは、ある細胞株や関連する組織において標的の発現が高いか低いか、あるいは標的の発現がアゴニストやアンタゴニスト処理によってわずかに変化するといったような、実際の生物学をより反映するものです。つまり、レンジ試験の結果は有意ですが、バイナリー評価で得られるデータほど明確ではなく、解釈が難しくなります。
レンジ戦略による保証には、遺伝子・タンパク質発現を阻害するsiRNAなどの方法が含まれますが、必ずしも完全な除去が得られるとは限られません。これらの技法は処置されたサンプルを元の材料と直接比較できるため、抗体検証に多大な価値を生み出し、また多くの場合より簡便に確立させることができます。バイナリー試験で記述したように、レンジ試験は発現を確認するため直交的戦略と組み合わせる必要があります。
レンジモデルの原型的な例は、タンパク質発現またはシグナルの程度が異なる複数のサンプルの使用です。これは実験データを過去に発表された、または予測される解析と相関させることが可能である一方、常に可能であるとは限らず、抗体の特異性と感度に対する信頼を築くためには複数の方法で評価する必要性を示しています。
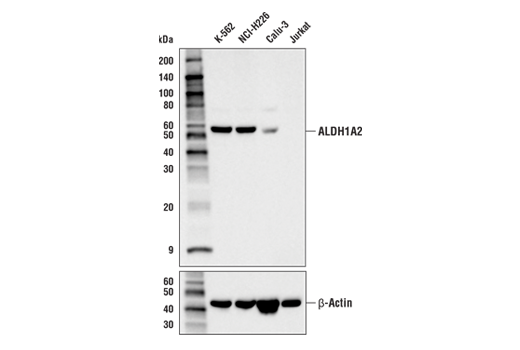
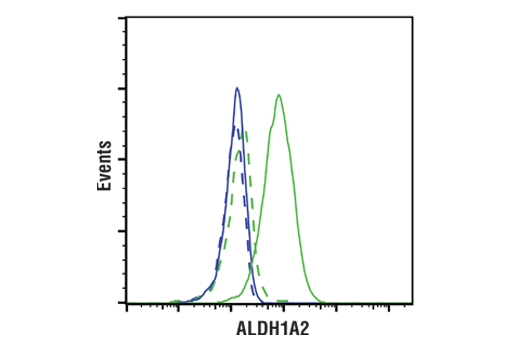
図1と2は、複数のサンプルを使用したレンジ戦略の例を示しています。図1は、各種細胞株からのライセートを調査するためにALDH1A2 (E6O6Q) rabbit mAbを用いて得られたウェスタンブロットデータを示しています。ALDH1A2がJurkatよりK-562細胞でより高度に発現しています。図2は、同じALDH1A2 (E6O6Q) 抗体を用いたK-562およびJurkat細胞のフローサイトメトリー解析を示しています。図から分るように、フローサイトメトリーとウェスタンブロットのデータは互いを裏付けており、ローディングコントロールによりサンプル (検体) が結果の誤った解釈の原因とならないようにしています。重要なことに、ALDH1A2は公表されているバイオインフォマティクスのデータベースと一致しており、直交戦略を示しています (ページ12参照)。
内因性発現が不適切な場合は、処理済みおよび未処理のサンプルを直接比較することは抗体特異性を評価するのに有用です。これは、適切なモデルが採用できるように標的の生物学的役割を理解することの重要性を明確に示しています。
図3、4、および5は、未処理のHT-29細胞とRRM2の発現を誘導するためにアフィジコリンで処理したHT-29細胞を、RRM2 (E7Y9J) rabbit mAbを用いて生成したデータを示しています。ウェスタンブロット、免疫組織化学染色、および免疫細胞化学解析からPRM2の発現がバイナリーでなく、アフィジコリンによる処理後に低度から高度に移行することが分かります。抗体を使用するアプリケーションごとにモデルを試験すると、そのアプリケーションにおける抗体の特異性が保証されます。
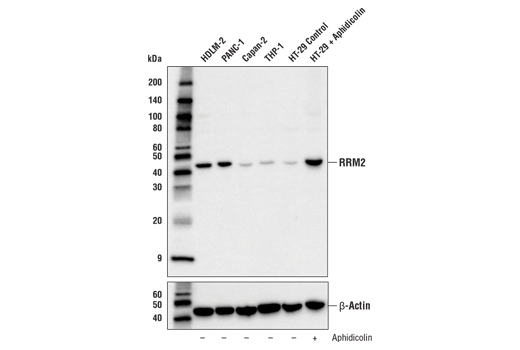
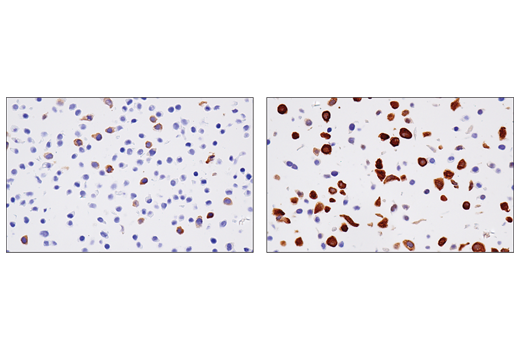
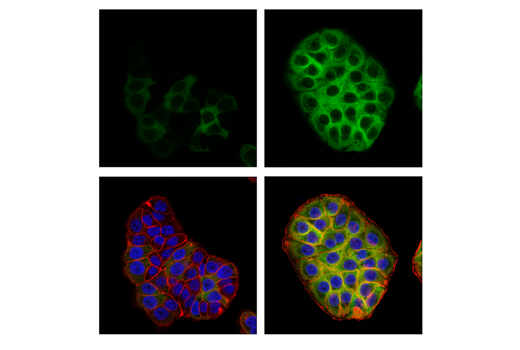
図1 - 5に示すデータは各種サンプル間、または慎重に選ばれた処理後の標的の発現の明白な差を示していますが、シグナルが完全に失われたものは1つもありません。したがって特異性を確認し、実験結果を検証するためには複数のモデルの採用が必要です。これらのモデルを用いて得られた結果は、発表されている生物学的または直交的データと一致しており、他のアプリケーションまたは技法で得られた結果による裏付けがある必要があります。
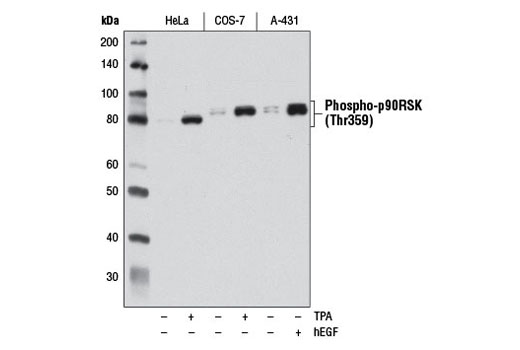
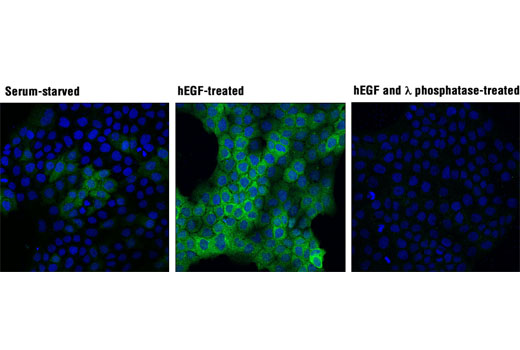
図6および7は、標的の既知の生物学的機構と一貫性のある方法で、リン酸化p90RSK (Thr359) rabbit mAb を検証するために、複数のモデルと処理を使用したところを示しています。図6は、血清飢餓と12-O-Tetradecanoylphorbol-13-acetate (TPA) またはhuman epidermal growth factor (hEGF) による処理後のHeLa細胞、COS-7、およびA-431細胞から調製されたライセートのウェスタンブロット解析を示しています。規定の条件下では、標的の発現が明らかに上昇しています。図7では、hEGFでの処理後のA-431細胞の免疫細胞化学解析に同じ抗体を用いています。同じモデルが両方のアプリケーションで使用されており、独立したアッセイの結果が互いを裏付けています。
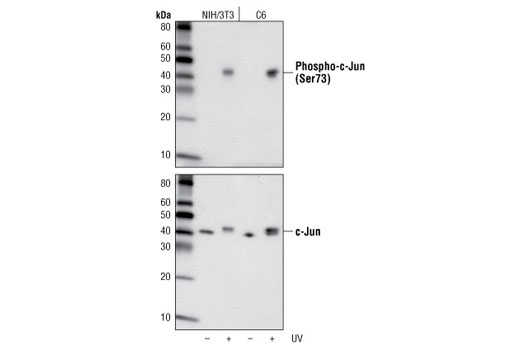
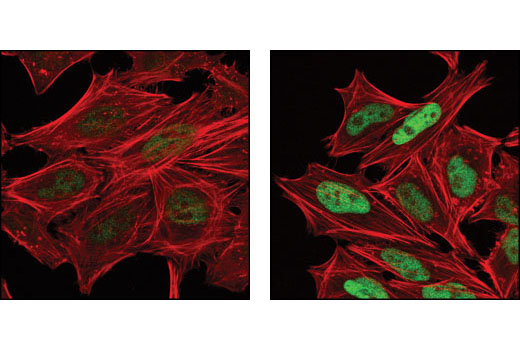
抗体の感度は異なる状況下やアプリケーション間で大きく異なることがあります。これは、図8および9に示すように、1つのアプリケーションでバイナリーデータのように見える検証が、実は他のアプリケーションでは範囲データであるということを意味します。図8は、UV光線への暴露後のNIH/3T3およびC6細胞から調製したライセートにおけるphospho-c-Jun (Ser73) の発現のウェスタンブロット解析を示しています。これらの細胞株とこのアプリケーションでは、処理済みサンプルだけでシグナルが検出可能となっており結果はバイナリーであるように見受けられます。図9では、Anisomycinによる処理後のHeLa細胞の免疫細胞化学解析に同じ抗体を用いています。ここでは、シグナルは弱く見えますが未処理細胞で検出可能です。
phospho-c-Junシグナルはウェスタンブロットの未処理レーンでは欠如していますが、これは標的そのものが欠如しているという意味ではないということに注目することが重要です。これはただ単に、シグナルがウェスタンブロットアプリケーションでは検出の閾値未満であるという場合があります。さらに、未処理細胞集団の免疫細胞化学解析では弱いシグナルが検出できますが、これはこのアプリケーションで感度がより高いことを示しているか、非特異的結合を反映している可能性があります。これらの理由から、1つの実験で得られた観察を裏付けるために常に複数の方法を採ることが重要です。