View in English?
View in English?
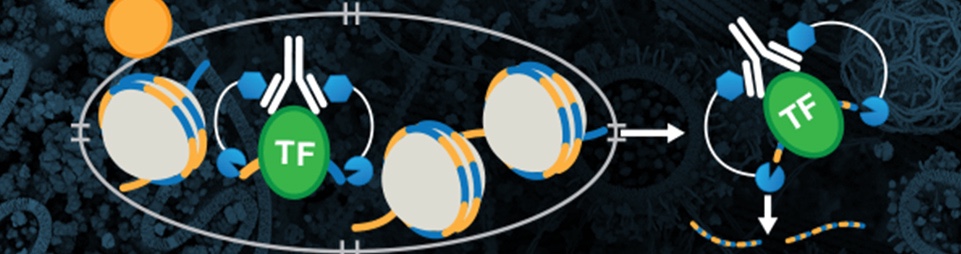
Cleavage Under Targets & Tagmentation (CUT&Tag) は、CUT&RUNと同様に、より迅速で低コストなChIP-seqの代替となる解析方法です。CUT&Tagは、ChIP-seqに比べてより少ないサンプル量、簡単なワークフロー、より低いシーケンシングコストでクロマチンをプロファイリングできます。また、バックグラウンドがより低いため、S/N比が向上します。CUT&Tagは、ライブラリー調製の大半のステップをin vivoで行うため、CUT&RUNよりも迅速でありながら、CUT&RUNと同等のデータを取得できます。また、シングルセル解析が可能です。
Cell Signaling Technology®のCUT&Tag試薬とCUT&Tagキットは、他の製品と同様に、その性能について厳密に検証されています。また、CSTは、これらと同じ試薬をCUT&Tag抗体の検証に用いているため、その性能と信頼性は常に保証されています。
従来のChIPとChIP-seqは、クロスリンクしたクロマチンのプロファイリングに用いられますが、CUT&TagとCUT&RUNは、どちらも未変性のクロマチンのプロファイリングに使用できます。CUT&TagとCUT&RUNは、どちらも細胞膜の透過化を行うため、一次抗体は核膜孔を通って核内に進入し、そこで目的の標的に結合できます。適切なpAG-酵素融合体を抗体に結合させて、この酵素を活性化させると、抗体が結合している部位の両側のDNAが切断されます。
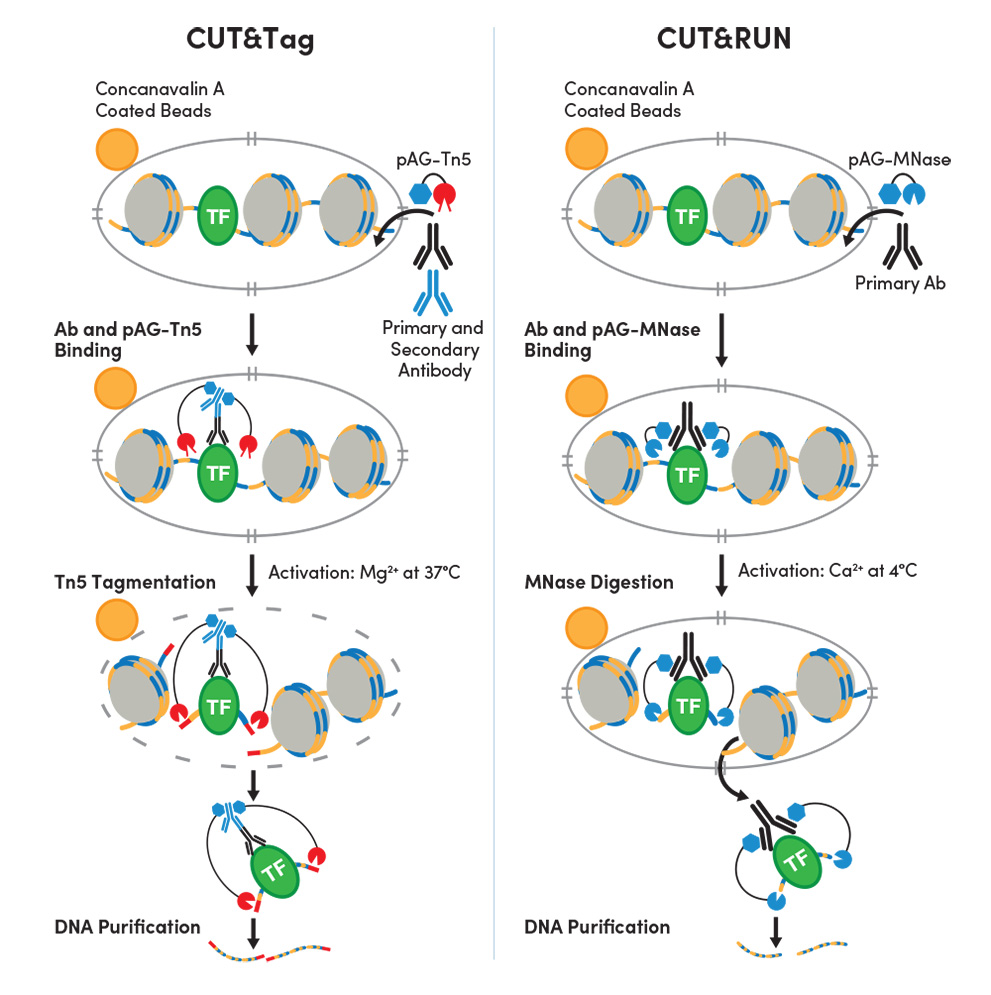
図1:CUT&Tagのワークフロー (左) は、DNAライブラリーの調製にかかる時間を短縮しながらも、確かなタンパク質-DNA相互作用データを提供できます。
CUT&Tagの利点:
| より短時間で結果を取得 | 細胞からのDNAライブラリー調製は1-2日で完了。CUT&Tagでは、ライブラリー調製が効率化されているため、CUT&RUNと比べて25%の時間短縮が可能 |
| 少量のサンプルで解析可能 | ChIP-Seqに比べて、約40分の1のサンプル量1 |
| 低深度のシーケンシング = シーケンシングコストが低減 | バックグランドが低いため、必要な高品質リードはわずか約200万リード |
CUT&TagとCUT&RUNは、どちらも時間やサンプルが十分でない場合のタンパク質-DNA相互作用の解析に役立ちます。
以下の表を参考に、どちらの方法が適しているかをご検討ください。
| CUT&Tag | CUT&RUN | |
|---|---|---|
| ヒストンとの適合性 | ✔ | ✔ |
| 転写因子との適合性 | 条件次第 | ✔ |
| コファクターとの適合性 | 条件次第 | ✔ |
| qPCRとの適合性 | X | ✔ |
| NG-seqとの適合性 | ✔ | ✔ |
| DNAライブラリー調製 | In vivo | In vitro |
| 細胞からのDNAライブラリー調製 | 1-2日 | 2-3日 |
| 少量の細胞 | ✔ | ✔ |
| シングルセル解析 | ✔ | X |
| シーケンシング深度 | 200万 | 300万-500万 |
CUT&Tagは、次世代シーケンシング (NGS) に適しており、サンプルと時間が限られている際の「ヒストン修飾がクロマチン結合をどのように制御するか」の研究に最適です。また、お客様自身やCSTなどの抗体サプライヤーにより、CUT&Tag用に特別に検証された抗体を用いれば、転写因子の研究にも活用できます。
CUT&Tag実験に必要な試薬がすべて含まれたCST® CUT&Tag Assay Kit #77552の注文、または必要な試薬のみの購入が可能です。弊社は、すべてのCUT&Tag試薬に対し厳密な社内検証を行っており、常に高品質な試薬をお届けすることを保証します。また、CSTが提供するCUT&Tag検証済み抗体の拡大中の製品リストから、抗体をお選びいただくこともできます。
CUT&Tag試薬を用いることにより、ライブラリー調製にかかる時間は半分で、CUT&RUNと同等の高品質なデータが得られます。
CUT&Tag Assay Kit #77552とCUT&Tag Dual Index Primers and PCR Master Mix for Illumina #47415を用いることにより、ChIP-seqやCUT&RUNと同等のデータが得られます。また、Tri-Methyl-Histone H3 (Lys4) やTri-Methyl-Histone H3 (Lys27) などのヒストン修飾の研究の際は、カタログ製品を使用します。たった100,000個の細胞からDNAライブラリーの調製までを、わずか1-2日間で完了できます (図2)。
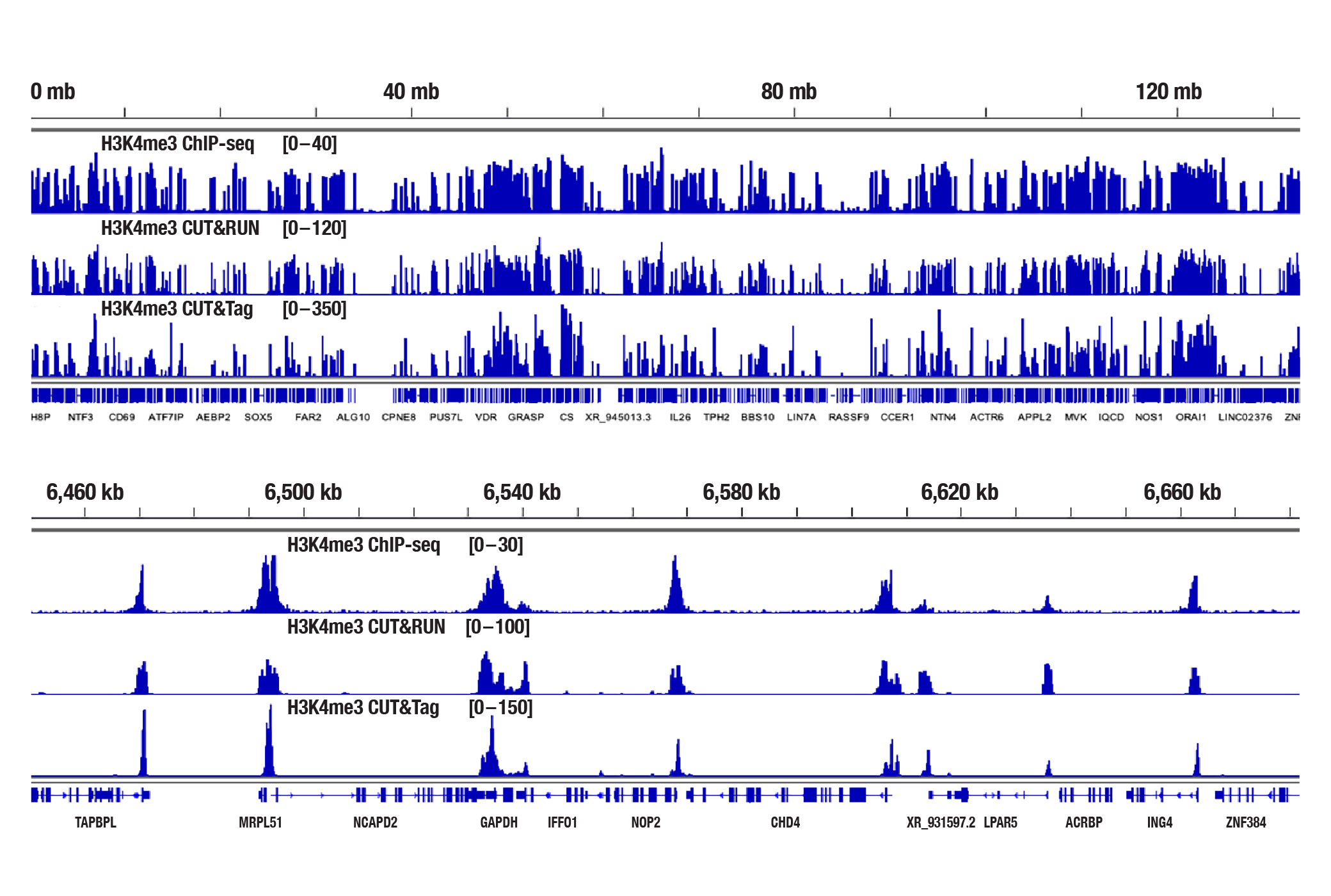
図2:HCT 116細胞を、Tri-Methyl-Histone H3 (Lys4) (C42D8) Rabbit mAb #9751を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina (ChIP-seq, CUT&Tag) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina #47415を用いてDNAライブラリーを調製しました。図は、12番染色体全体にわたる結合 (上) と、そこに含まれるH3K4me3の既知の標的遺伝子であるGAPDHへの結合 (下) を示しています。
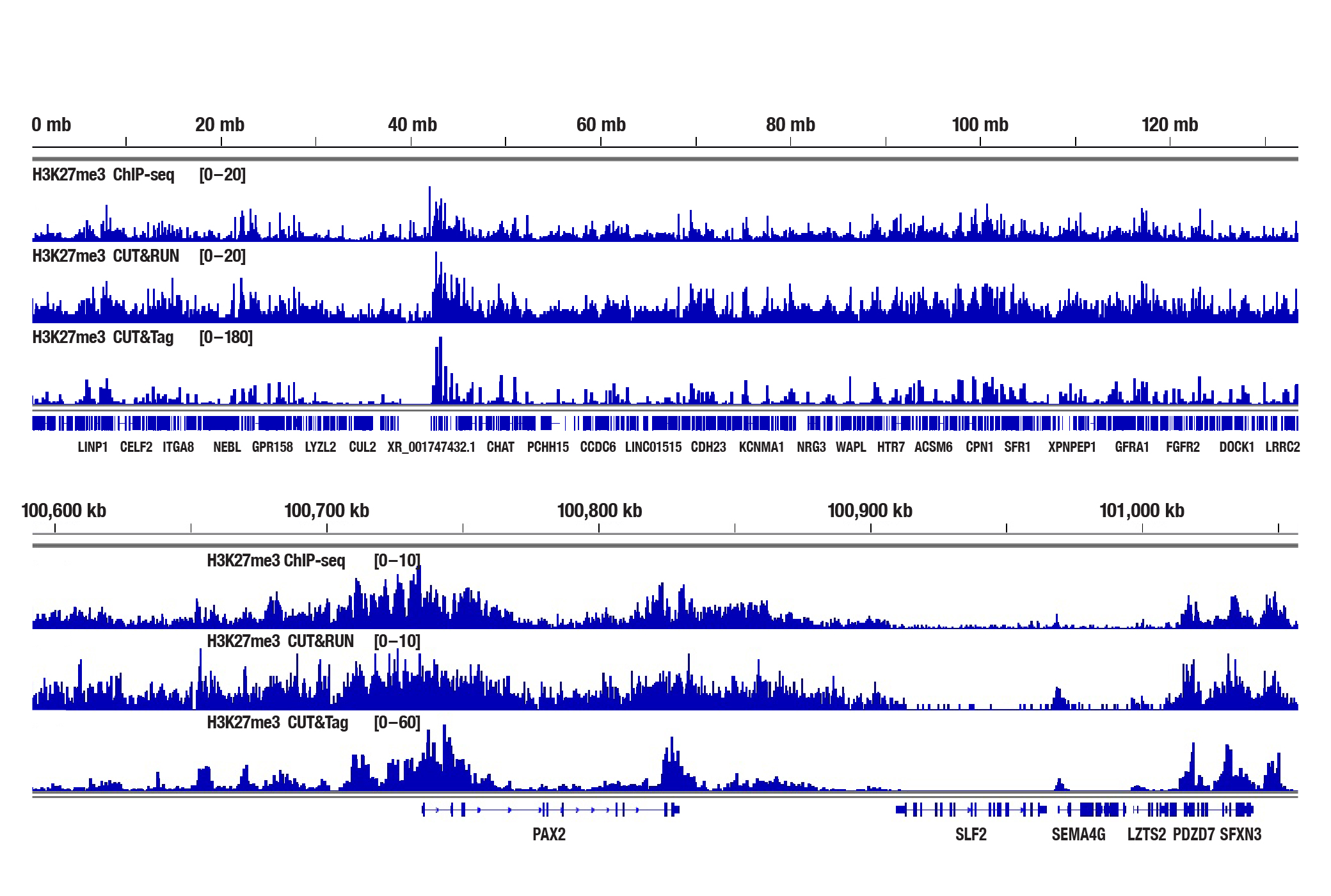
図3:NCCIT細胞を、Tri-Methyl-Histone H3 (Lys27) (C36B11) Rabbit mAb #9733を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina Systems (ChIP-seq, CUT&RUN) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #47415を用いてDNAライブラリーを調製しました。図は、10番染色体全体にわたるH3K4me3の濃縮 (上) と、そこに含まれるPAX2遺伝子の濃縮 (下) を示しています。
CUT&Tag Assay Kit #77552とCUT&Tag Dual Index Primers and PCR Master Mix for Illumina #47415を用いることにより、ChIP-seqやCUT&RUNと同等のデータが得られます。Nanog (図4) やEstrogen Receptor α (図5)、JARID2 (図6) などの転写因子またはコファクターの研究の際は、CUT&Tag検証済み抗体を使用します。たった100,000個の細胞からDNAライブラリーの調製までを、わずか1-2日間で完了できます。
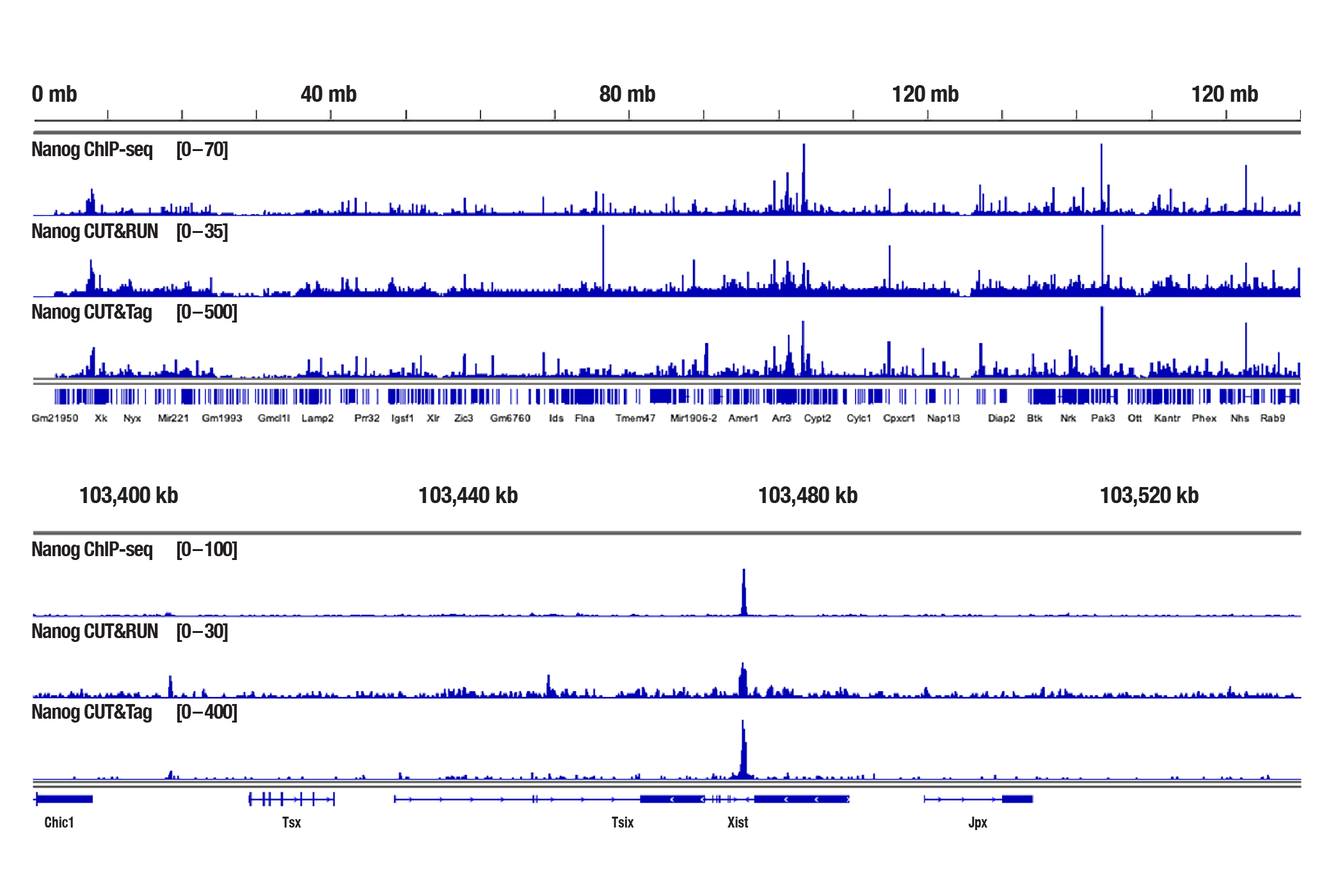
図4:F9細胞を、Nanog (D2A3) XP Rabbit mAb (Mouse Specific) #8822を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina (ChIP-seq, CUT&Tag) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina #47415を用いてDNAライブラリーを調製しました。図は、X染色体全体への結合 (上) と、そこに含まれるNanogの既知の標的遺伝子であるXist (下) への結合を示しています。
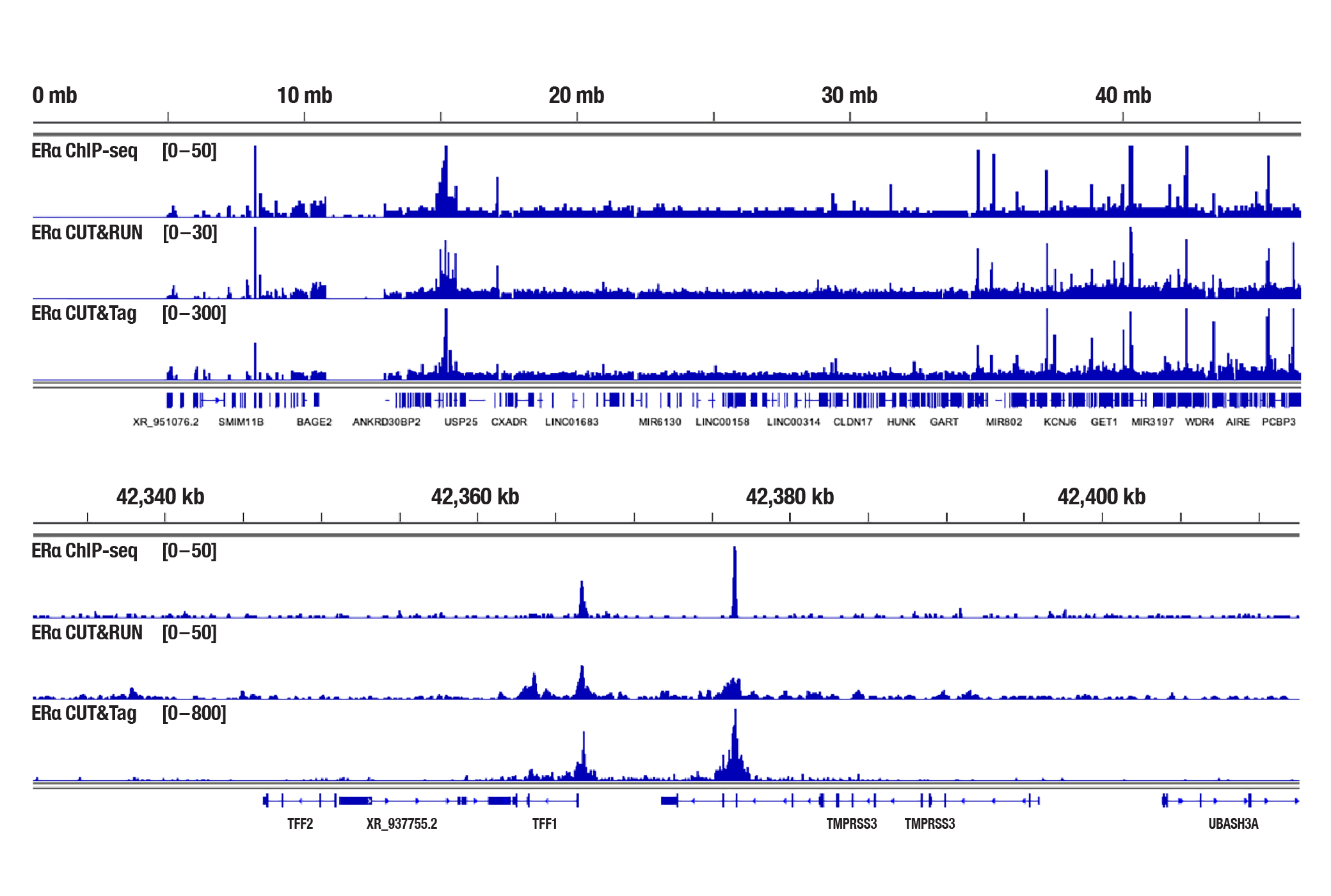
図5:フェノールレッドフリー培地と5%活性炭処理済みFBSで4日間培養した後、β-estradiol (10 nM) で45分間処理したMCF7細胞を、Estrogen Receptor α (D8H8) Rabbit mAb #8644を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #47415を用いてDNAライブラリーを調製しました。図は、21番染色体全体への結合 (上) と、そこに含まれるEstrogen Receptor αの既知の標的遺伝子であるTFF1への結合 (下) を示しています。
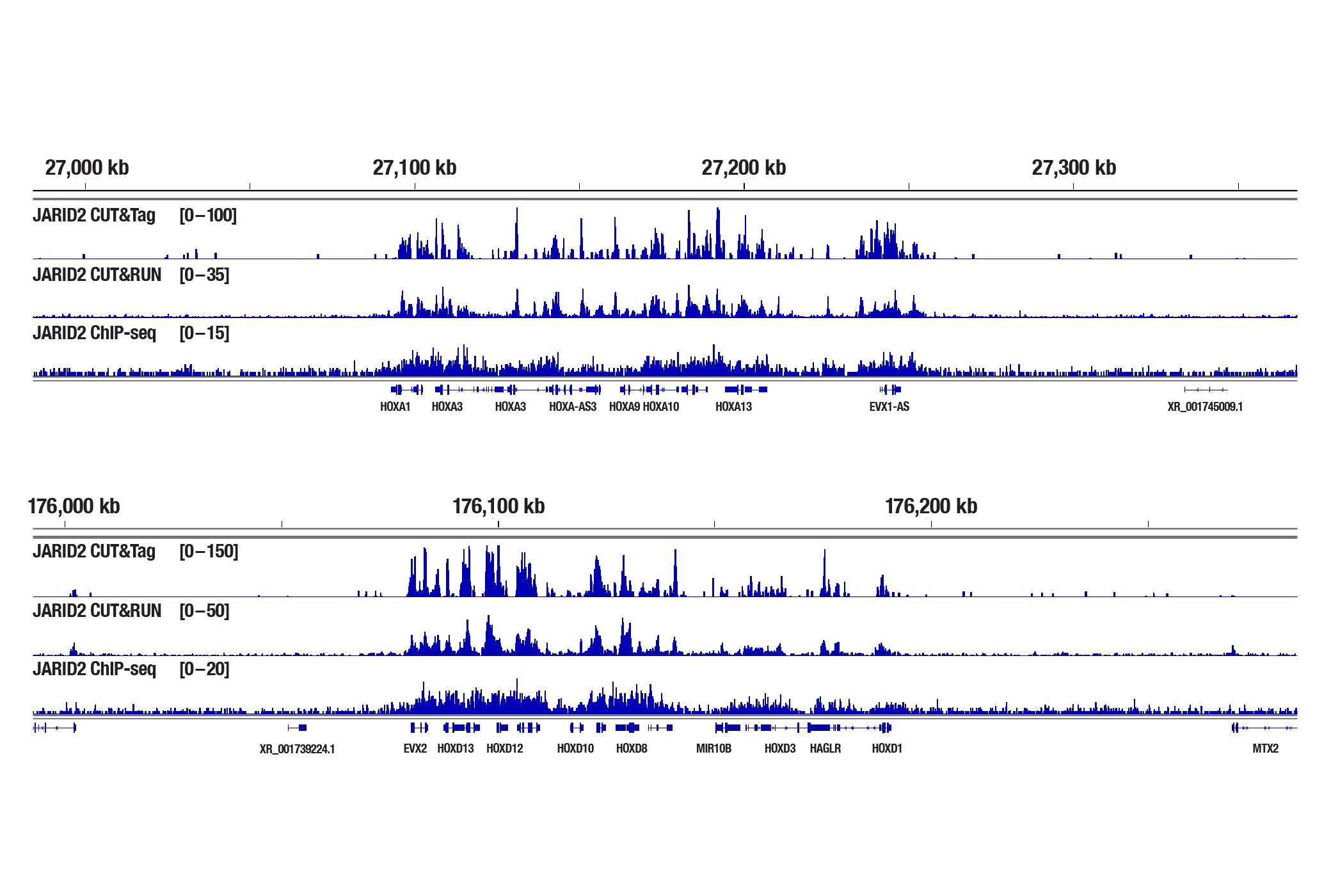
図6:NCCIT細胞を、ARID2 (D6M9X) Rabbit mAb #13594を用いてCUT&Tag、CUT&RUN、ChIP-seqの各アッセイで解析しました。各アッセイにはそれぞれ、CUT&Tag Assay Kit #77552、CUT&RUN Assay Kit #86652、SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina Systems (ChIP-seq, CUT&RUN) #47415、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #56795を用いてDNAライブラリーを調製しました。図は、HOXA遺伝子の濃縮の比較 (上) と、下パネルにHOXD遺伝子の濃縮の比較 (下) を示しています。 いずれもJARID2の既知の標的遺伝子です。
CUT&Tagを用いて、組織サンプルのヒストンマークを解析することもできます。組織内の転写因子またはコファクターの解析には、CUT&RUN Assay Kit #86652を推奨します。
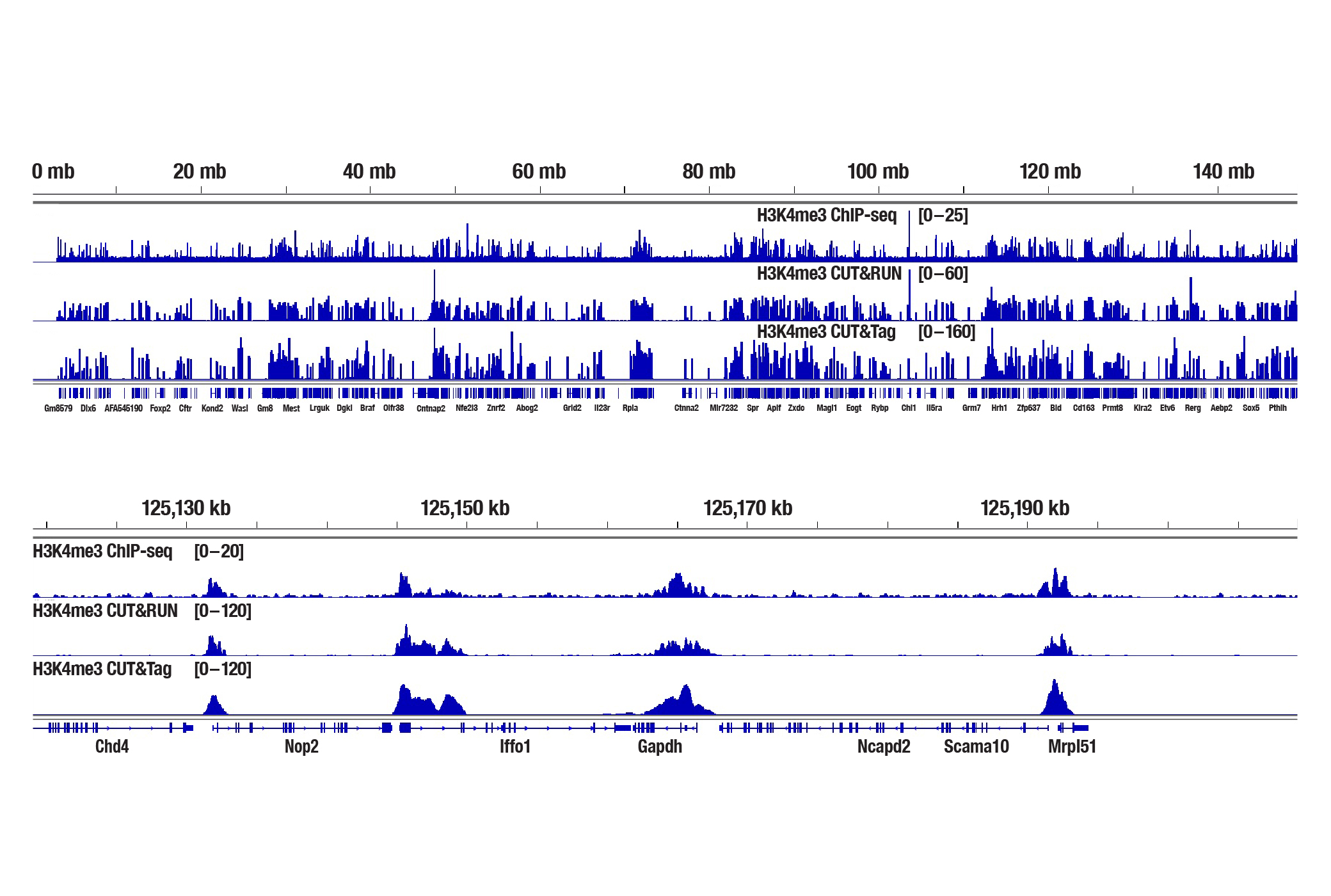
図7:新鮮なマウス脳組織25 mg (ChIP-seq) または1 mg (CUT&RUNおよびCUT&Tag) を、Tri-Methyl-Histone H3 (Lys4) (C42D8) Rabbit mAb #9751を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina Systems (ChIP-seq, CUT&RUN) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #47415を用いてDNAライブラリーを調製しました。図は、6番染色体全体にわたるH3K4me3の濃縮 (上) と、そこに含まれるH3K4me3の既知の標的遺伝子であるGAPDHの濃縮 (下) を示しています。
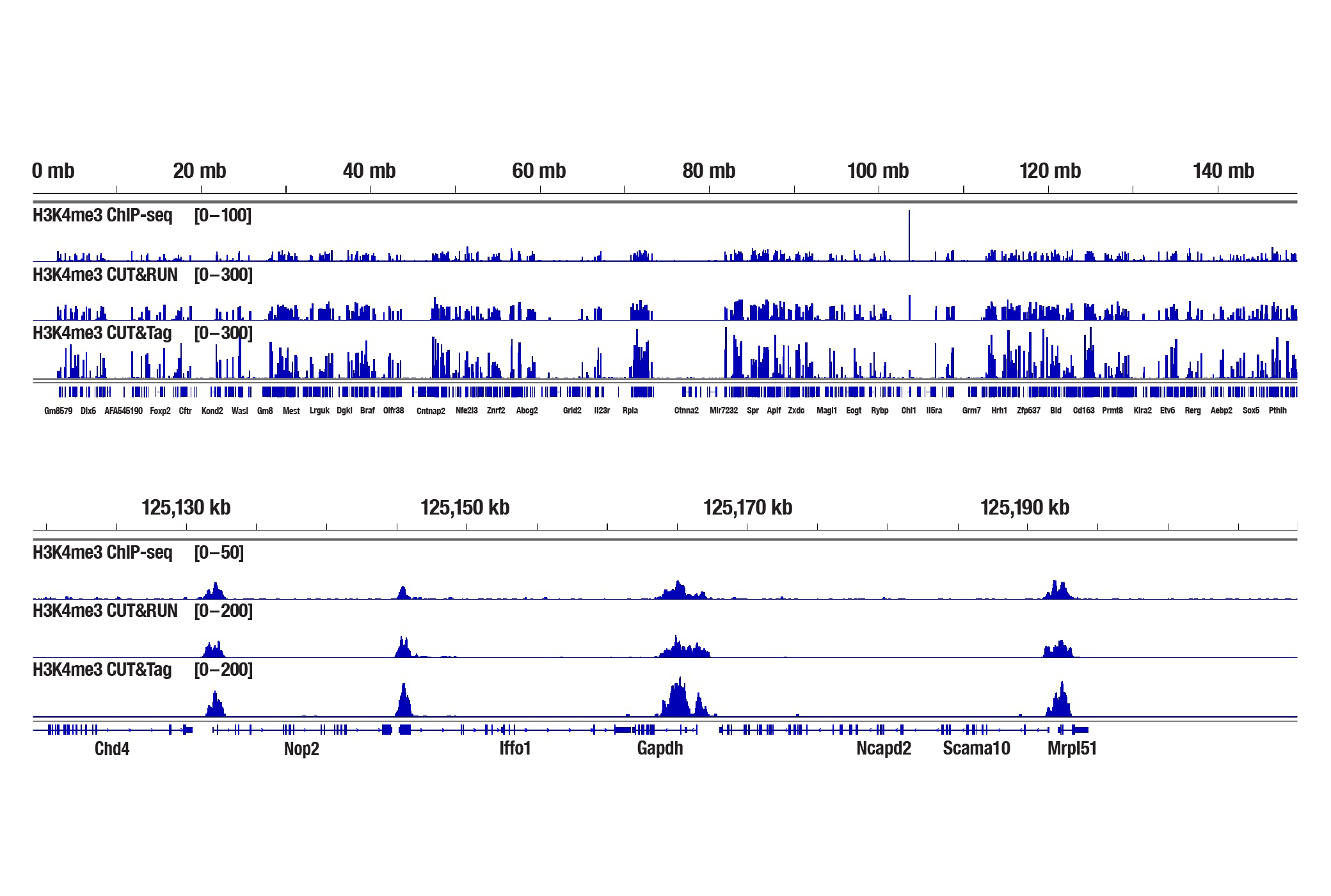
図8:新鮮なマウス肝臓組織25 mg (ChIP-seq) または1 mg (CUT&RUNおよびCUT&Tag) を、 Tri-Methyl-Histone H3 (Lys4) (C42D8) Rabbit mAb #9751を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina Systems (ChIP-seq, CUT&RUN) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #47415を用いてDNAライブラリーを調製しました。図は、6番染色体全体にわたるH3K4me3の濃縮 (上) と、そこに含まれるH3K4me3の既知の標的遺伝子であるGAPDHの濃縮 (下) を示しています。
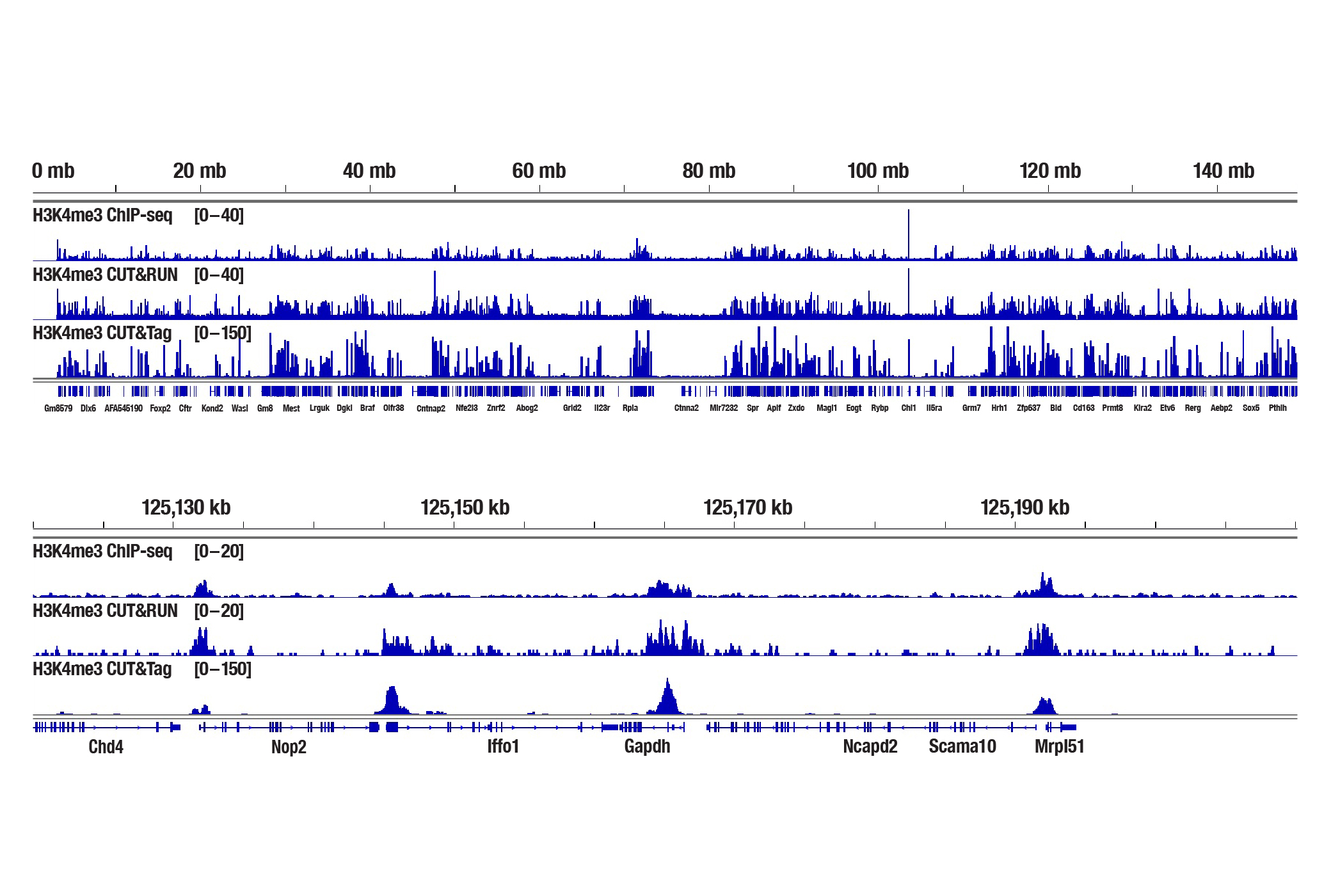
図9:新鮮なマウス心臓組織25mg (ChIP-seq) または1 mg (CUT&RUNおよびCUT&Tag) を、Tri-Methyl-Histone H3 (Lys4) (C42D8) Rabbit mAb #9751を用いてChIP-seq、CUT&RUN、CUT&Tagの各アッセイで解析しました。各アッセイには、それぞれSimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005、CUT&RUN Assay Kit #86652、CUT&Tag Assay Kit #77552を用いました。ChIP-seqとCUT&RUNサンプルにはDNA Library Prep Kit for Illumina Systems (ChIP-seq, CUT&RUN) #56795、CUT&TagサンプルにはCUT&Tag Dual Index Primers and PCR Master Mix for Illumina Systems #47415を用いてDNAライブラリーを調製しました。図は、6番染色体全体にわたるH3K4me3の濃縮 (上) と、そこに含まれるH3K4me3の既知の標的遺伝子であるGAPDHの濃縮 (下) を示しています。
精製したCUT&Tag DNAを、Agilent社のBioanalyzerやTapeStationシステムなどのプラットフォームでNGSに進むための品質チェックを行う前に、Thermo Fisher Scientific社のNanoDropやQubit Fluorometric Quantificationシステムなどのプラットフォームで定量できます。
計算上のDNAライブラリーの収量は、使用する定量方法によって異なることにご注意ください。詳細は、CSTのブログ「CUT&Tag DNAライブラリー収量:Agilent BioanalyzerまたはTapeStationシステムでの検出に足りない場合」をご覧ください。
CUT&Tagの閾値は、ChIP-seqやCUT&RUNよりも低くなっています。そのため、どのCUT&Tag試薬を使用していたとしても、Agilent社のBioanalyzerまたはTapeStationシステムでのプロファイリングでピークが非常に弱いまたはピークがみられない場合にもDNAライブラリーのシーケンスを正常に行うことができます (図10a)。BioanalyzerまたはTapeStationシステムでのシグナルが低い場合でも、高いゲノミクスシグナルを含むシーケンシングデータが取得可能であるため、シーケンシングに進むことを推奨します (図10b)。
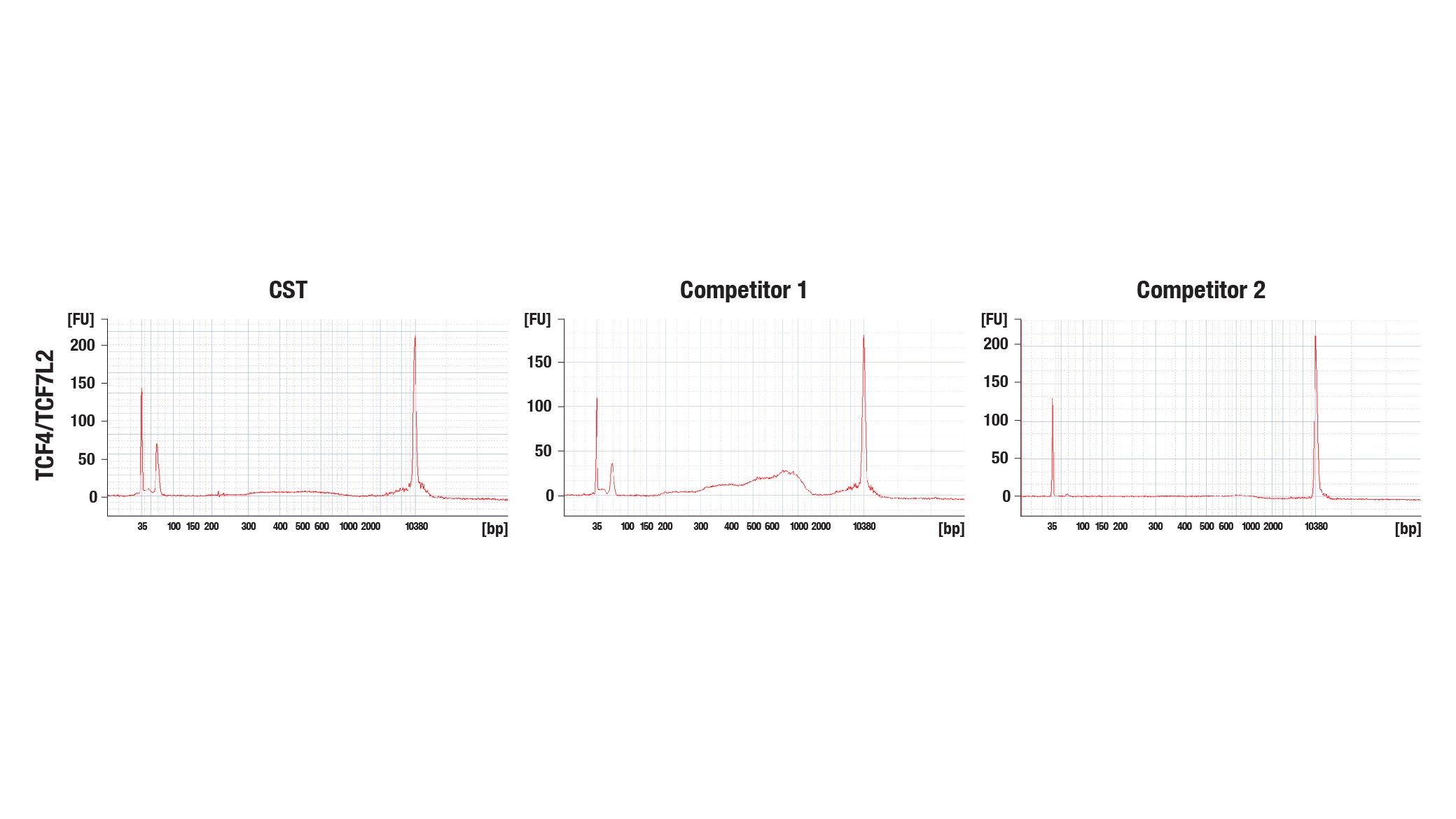
図10a:他社製品を含むいくつかのpAG-Tn5と、HCT 116細胞およびTCF4/TCF7L2 (C48H11) Rabbit mAb #2569を用いて、CUT&Tagを行いました。用いた各酵素の使用量は、メーカーの推奨量に基づいています。DNAライブラリーは、CUT&Tag Dual Index Primers and PCR Master Mix for Illumina #47415を用いて調製しました。図は、BioanalyzerシステムによるCUT&TagライブラリーDNAのプロファイリングを示しています。同じDNAライブラリーをシーケンシングし、そのNGSトラックを図10bに示しています。
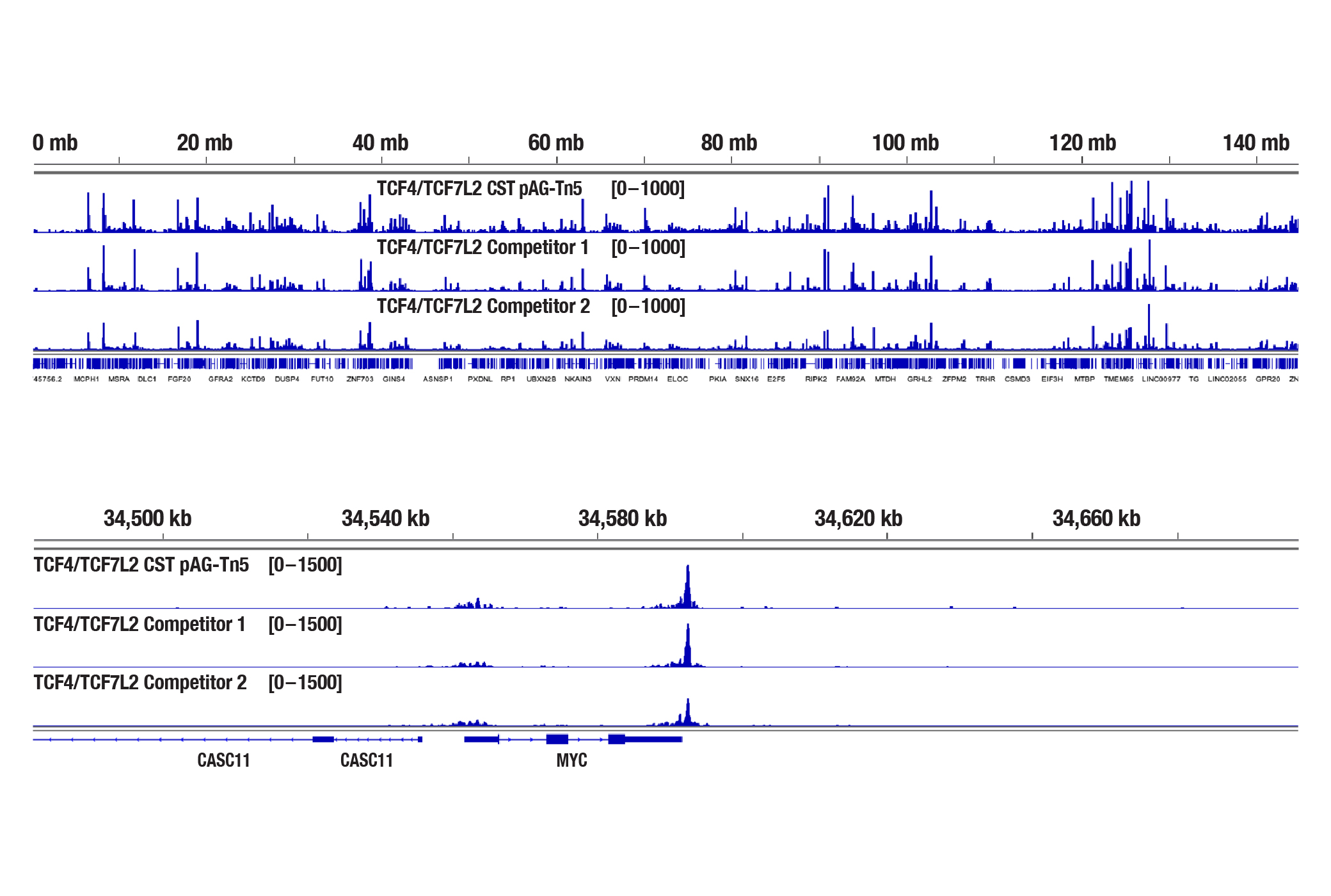
図10b:図10aのBioanalyzerシステムで解析したDNAライブラリーをシーケンシングし、そのNGSトラックを示しています。このNGSデータは、8番染色体全体へのTCF4の結合 (上) と、そこに含まれるTCF4の既知の標的遺伝子であるMYCへの結合 (下) を示しています。
または、既知のポジティブおよびネガティブ遺伝子座に対するプライマーを用いてCUT&Tag DNAライブラリーのqPCRを行い品質チェックを行い、NGSの前にクロマチン断片の濃縮率を決定できます。
CSTのCUT&Tagキットやカタログ試薬は、実際に実験を行う科学者と該当領域の専門家で構成される弊社のエピジェネティクスアプリケーションチームによって社内で検証されており、確実に機能することが保証されています。下記よりワークフローに適したソリューションを見つけてください。
| 製品番号 | 製品 |
|---|---|
| 77552 | CUT&Tag Assay Kit |
| 79561 | CUT&Tag pAG-Tn5 (Loaded) |
| 47415 | CUT&Tag Dual Index Primers and PCR Master Mix for Illumina |
| 63228 | CUT&Tag PCR Master Mix |
| 35401 | Goat Anti-Rabbit IgG (H&L) Antibody |
| 52885 | Donkey Anti-Mouse IgG (H&L) Antibody |
| 2729 | Normal Rabbit IgG |
| 68860 | Normal Mouse IgG |
| 14209 | DNA Purification Buffers and Spin Columns (ChIP, CUT&RUN, CUT&Tag) |
| 93569 | Concanavalin A Magnetic Beads and Activation Buffer |
| 16359 | Digitonin Solution |
| 27287 | 100X Spermidine |
| 7012 | Protease Inhibitor Cocktail (200X) |
| 10012 | Proteinase K (20 mg/ml) |
| 20533 | 10% SDS Solution |
| 7011 | 0.5M EDTA, pH 8.0 |
| 31415 | 10X Wash Buffer Binding Buffer (CUT&RUN, CUT&Tag) |
| 15338 | CUT&RUN Antibody Binding Buffer (CUT&RUN, CUT&Tag) |
CST, Cell Signaling Technology, XP, and SimpleChIP are trademarks or registered trademarks of Cell Signaling Technology, Inc. All other trademarks are the property of their respective owners. Visit cellsignal.com/trademarks for more information.
CUT&Tag provided under a license from Active Motif, Inc. under U.S. Patent No. 10,689,643 and 9,938,524, foreign equivalents, and child patents deriving therefrom. For purchaser's internal research use only. May not be used for resale, services, or other commercial use.
U.S. Patent No. 11,733,248, foreign equivalents, and child patents deriving therefrom.
U.S. Patent No. 7,429,487, foreign equivalents, and child patents deriving therefrom.