View in English?
View in English?
ELISAには一般的に用いられるいくつかの方法があります。これらの方法 (あるいはその変法) の中から、実験目的、使用可能なサンプルや材料、検出方法などによって適切な方法を選択します。
直接ELISAは、マイクロプレート表面に結合した抗原を、標識した検出 (結合) 抗体で直接検出します。これに対して間接ELISAでは標識した二次抗体で検出を行います。
簡単に説明すると、マイクロプレート表面を抗原でコーティング、固相化した後、検出抗体の非特異結合を防ぐため、ブロッキング剤を加えます。次に酵素 (HRPなど) で直接標識した検出抗体を反応させ、その後、標識した酵素の基質を加えます。さらに短時間インキュベーションした後stop solutionを加えます。
直接ELISAが全体的に最もシンプルにデザインされています。
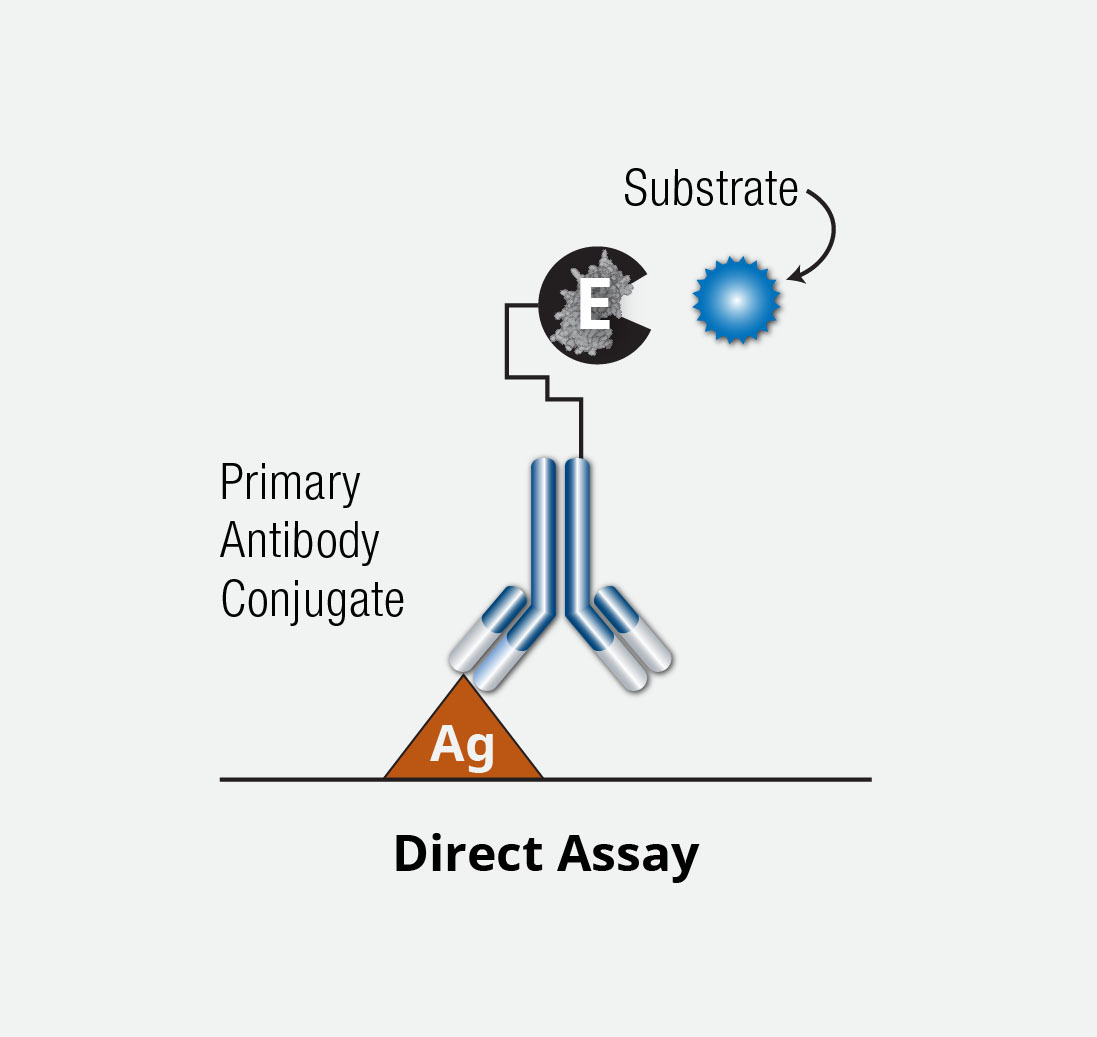
ELISA直接法アッセイ
直接ELISAと類似していますが、間接ELISAでは標識した二次抗体を使って結合抗体を検出します。
固相化やブロッキングなど、最初のステップは直接ELISAと大体同じです。検出 (結合) 抗体を加えますが、直接ELISAとは異なり、この抗体は未標識の物を用います。そして酵素で標識した二次抗体を加えて最初の結合抗体を検出します。もう一度洗浄のステップを行った後、基質の反応を行い、stop solutionを加えます。最後にプレートリーダーを使ってシグナルを検出します。
二次抗体または二次/三次抗体を検出に用いることでシグナルが増幅しますが、直接法に比べて行程が複雑で時間もかかります。
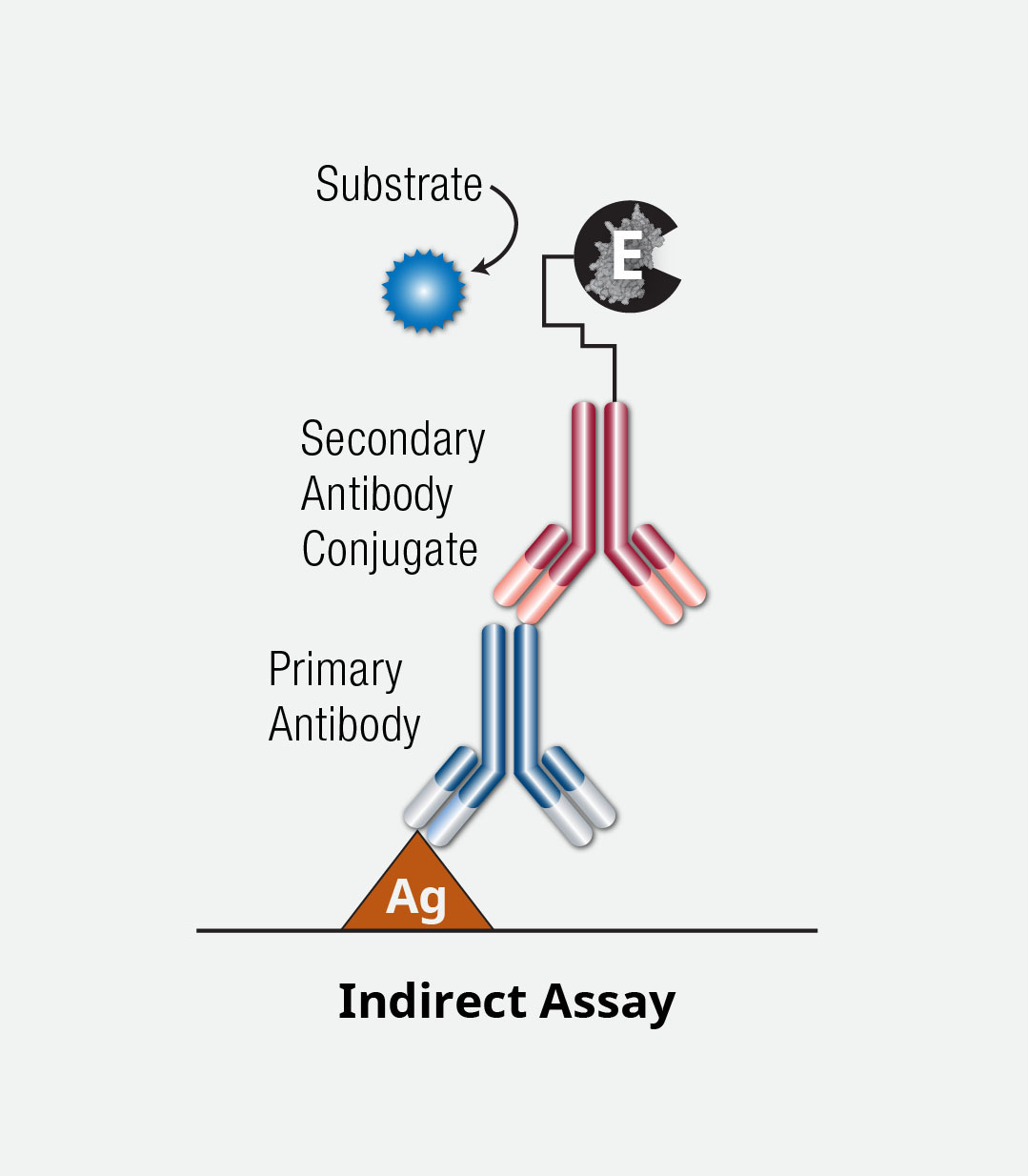
ELISA間接法アッセイ
サンドイッチELISAでは、抗原ではなく捕捉抗体をELISAプレートに吸着させます。さらに抗原は、捕捉抗体と検出抗体の2つの抗体で認識させ、これにより「サンドイッチ」のような複合体ができます。
簡単に説明すると、捕捉抗体を固相化した後、余剰抗体の洗浄、ブロッキングを行い、標的抗原を含むサンプルをマイクロウェルに加えます。さらに捕捉抗体と同一抗原の別部位に結合する検出抗体を加えます。検出抗体を直接酵素標識するか、検出抗体に結合する酵素標識二次抗体をさらに加えます。ウェルを洗浄した後、標識酵素の基質を加えて短時間のインキュベーションを行い、stop solutionを加えます。各ウェルのシグナルは、標準的なプレートリーダーで測定します。
CSTは従来の固相のELISAをベースにデザインされたPathScan®や、液相ベースにデザインされたFastScan™など、いくつかのタイプのサンドイッチELISAキットをご用意しています。どちらの技法もサンドイッチベースのアッセイ形式ですが、後者は行程数と洗浄操作が少なく結果が早く得られます。これは、抗体と解析対象のサンドイッチ複合体を溶液中で形成させて、親和性タグでこれをプレート上に捕捉するようにデザインされているためです。詳細情報はこちらからご覧いただけます。
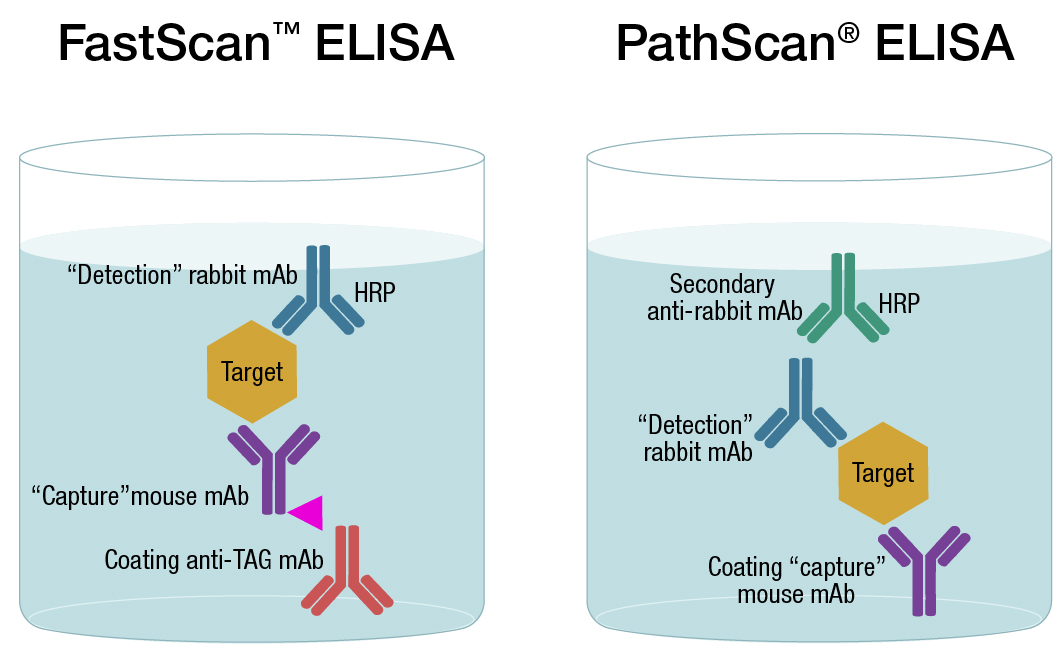
PathScanとFastScan ELISA抗体-CaptSureの比較
競合ELISAは阻害ELISA、ブロッキングELISAとも呼ばれます。この方法では予想されるシグナル (リファレンスシグナル) への干渉効果を定量化することで、サンプル中の標的分子量を推定します。
競合ELISAには、次の2つの方法があります。すなわち、1) マイクロプレートに標的分子に特異的な抗体を固相化する方法、 2) マイクロプレートに標的分子を固相化する方法、の2つです。1) の場合、サンプルに蛍光色素等で標識した標的分子を適量混ぜ合わせます。この混合物をプレートに加えることで、サンプル中に含まれる標的分子 (標識されていない) と標識された標的分子が固相化された抗体に競合的に結合します。したがって、サンプル中の標的分子が多いほどプレートに残る標識 (蛍光色素など) は少なくなります。2) の場合、サンプルに標的分子に特異的な抗体を適量混ぜ合わせます。この混合物をプレートに加えることで、サンプル中に含まれる標的分子と、固相化された標的分子が競合的に抗体を捕捉します。したがって、サンプル中の標的分子が多いほどプレートに捕捉される抗体は少なくなります。プレートに捕捉された抗体は、直接標識あるいは二次抗体によって検出します。
両者とも、洗浄操作後にプレートに残るシグナルはサンプル中の標的分子数に反比例します。1) 標識分子のみ、2) 抗体のみをプレートに加えたリファレンスシグナルや、既知濃度の標品で作成した検量線と対比して定量を行います。
| メリット | デメリット | |
|---|---|---|
| 直接 | 全体的にアッセイのセットアップが容易である | 検出に使う抗体すべてが標識されている必要がある |
| サンプル中の抗体量測定に適している | コーティングされた抗原が非特異的に表面に結合し、不自然な形で抗体に提示される可能性があるため、バックグラウンドシグナルが高くなることもある | |
| マルチプレックスに適していない | ||
| 間接 | 直接ELISAより高い感度が得られる | 手順の数が多いため、プロトコールは時間がかかる場合が多く、エラーが起こりやすい |
| 二次抗体に汎用性があり、様々なアッセイ、アプリケーションに転用できるのでコスト効率が高い | 必要な試薬の数が増えるため、非特異的結合とバックグラウンドシグナルの量が増える可能性がある | |
| 二次抗体がシグナルを増幅させる | ||
| サンドイッチ | 一般的に、標的分子の認識に2つの抗体を使用するため、特異性が高くなる | 抗体のマッチドペアの開発には、多くの費用と時間がかかる |
| 競合 | 検体濃度の低いサンプルや、低分子の定量的測定が可能である | |
| 免疫応答の測定有効である |
マルチプレックスELISAはサンプル中の複数のタンパク質を同時に解析する方法で、多くの場合、複数のサイトカインを同時に定量するのに利用されています。従来のELISAと異なり、この方法では、フローサイトメトリー、蛍光、化学発光、電気化学発光の技術を組み合わせて行います。
フローサイトメトリー解析が最もよく使われるマルチプレックスELISA法であり、ビーズに結合させた抗体を用います。フローサイトメトリーとビーズ結合抗体を使うことにより、他の方法より多くの数のサイトカインを測定することができます。