View in English?
View in English?
タンパク質の発現が非常に低い標的抗原や発現が未知の標的抗原の抗体検証には、組換えタンパク質や、代理細胞株における外来性のタンパク質発現が必要な場合があります。In vivoの状態をより正確に示す内因性の実験系が好まれていますが、不均一戦略にはいくつかの利点があります。
まず、タンパク質のアイソフォームや、保存性の高いファミリーメンバーと抗体の交差反応を検証するために不均一戦略を利用することができ、抗原の相同性に基づく抗体のオフターゲット結合の可能性に関して有用な情報を得ることができます。また、不均一戦略を用い、発現量の調整や組換えタンパク質の希釈による標的タンパク質のタイトレーションによって、抗体の感度試験を行うこともできます。
不均一戦略の他の使用方法としては、免疫沈降で機能する抗体の能力の検証や、ウェスタンブロットアプリケーションの標準ポジティブコントロールを生成することなどが挙げられます。さらに、微妙に異なる形態の多様なタンパク質を発現させる選択肢があるため、不均一戦略では部位特異的変異に対する抗体の特異性を検証することができます。
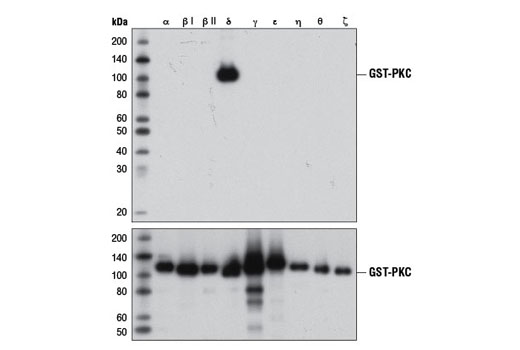
組換えタンパク質の一般的な使用方法は、タンパク質ファミリーのうち1つ以上に対する抗体の特異性の検証です。PKCδ (D10E2) Rabbit mAbの特異性を確認するため行った、9つの異なる組み換えPKCアイソフォームのウェスタンブロット解析を示した図1が、この良い例です。この場合、抗体の結合はアイソフォーム特異的であり、他の試験している組換えアイソフォームに対する標的外結合は観察されません。
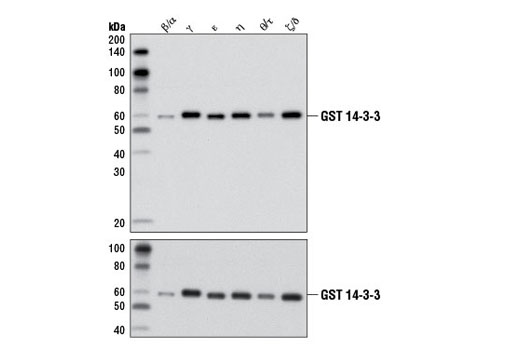
図2ではやや異なる方法を採り、14-3-3 (pan) 抗体のpan-reactivityを示しました。ウェスタンブロットのデータは、試験された6つの組み換えアイソフォームすべてを抗体が認識したことを示しており、アイソフォームの反応性を示すエビデンスとなっています。重要なことに、ローディングコントロールを含めたことにより、バンドの強度における違いがタンパク質のロードによるものであり、異なるアイソフォームに対する抗体の親和性の違いによるものではないことが分かります。
ここでの重要なポイントは、組換えタンパク質またはペプチドアレイは抗体の特異性と交差反応性を判断するために使用できるものの、これらのアッセイは人工的な性質を持つため、この2つの種類の方法から得られる結果は誤解を招くことがあります。さらにこれらのシステムの主な特色の一部は現在標準化が行われておらず、この事実からも不均一戦略は、このハンドブックに記述した他の保証方法で裏付ける必要性があることが分かります
外因性システム内で目的の抗原標的を発現するために設計されたDNAプラスミドは、組換えタンパク質の使用の人気のある代替法です。この戦略も主にアイソフォーム、ホモログ、およびオルソログとの抗体特異性と交差反応性を判断するために使われます。この方法で発現したタンパク質は、ウェスタンブロットまたは免疫蛍光細胞染色など確立された技術で簡便に解析できます。
外因性発現はエピトープタグ、哺乳類細胞に内因的に発現されないタンパク質、または限られた条件下のみで、またはまれな細胞集団内で発現するタンパク質を検証するのに必要なステップです。このような標的は内因性システム内では解析できないため、抗体特異性を確認するためには外因性発現が必要不可欠です。
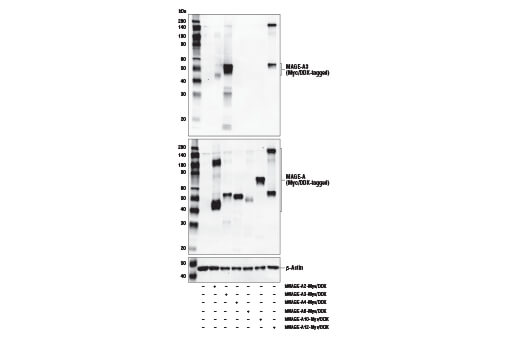
図3は、多様なMyc/DDKでタグ付けされたMAGEアイソフォームを発現する構造物でのトランスフェクションの後、293T細胞から調製したライセートを用いた、MAGE-A3抗体のウェスタンブロッティング解析を示しています。MAGE-A3は、多様な腫瘍細胞に発現することの多い核タンパク質で、293Tにより内在的に発現されることはありません。このデータは、トランスフェクションの成功を確認するDYKDDDK抗体とローディングコントロールとして用いるβ-Actin抗体の結果と、MAGE-A3に対する抗体の特異性を示しています。
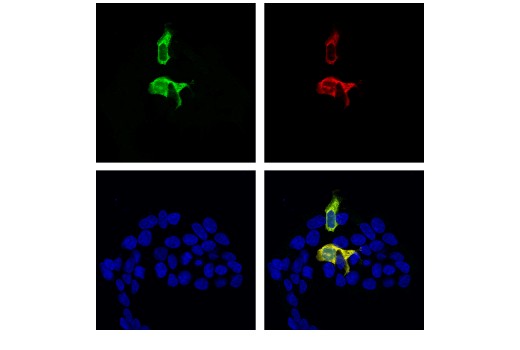
図4では、非天然的に発現したタンパク質Cas9に対する抗体の検証が、その目的とする実験使用と一致したモデル内に示されています。ここではmycでタグ付けされたCas9を、Cas9 (S. pyogenes) (E7M1H) rabbit mAbを用いて293T細胞内にトランスフェクトし免疫細胞化学染色を行いました。cDNAの発現を確認するため、Myc-Tag (9B11) Mouse mAbを使用しました。
不均一戦略は、限りない数の構造物を発現させることができるため、野生型タンパク質の発現に限られません。部位特異的抗体の特異性は、バクテリアまたは哺乳類細胞に外因的に・組換え的に発現されたタンパク質の部位特異的な変異体を使って確認できます。
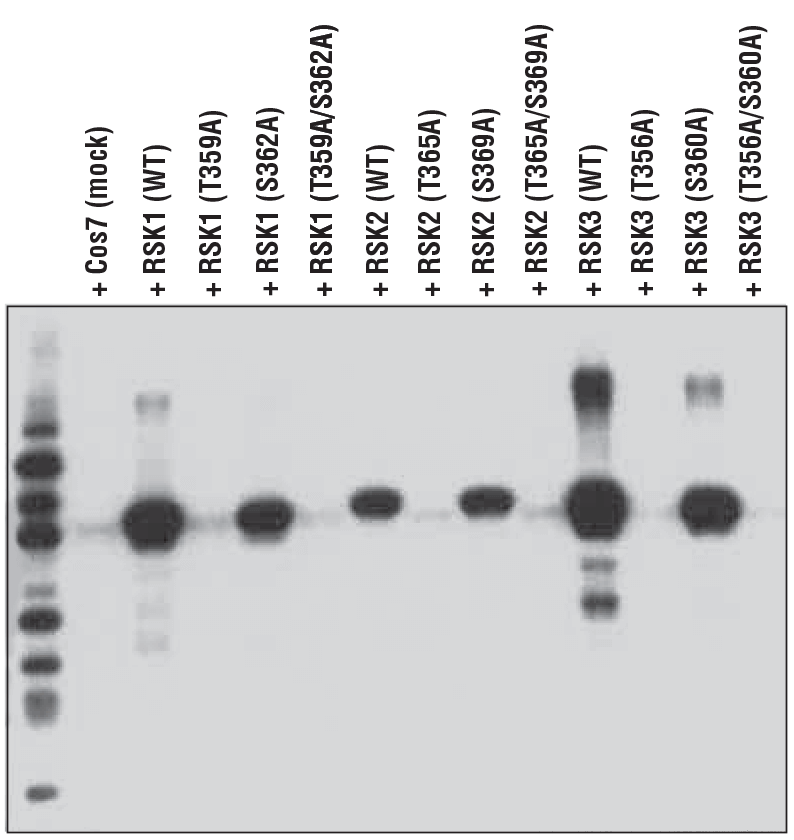
この概念を説明するために、図5では、Thr359-リン酸化の形態のp90RSKタンパク質に対するPhospho-p90RSK (Thr359) (D1E9) Rabbit mAbの特異性を示しています。ここでは、Thr359からAla (T359A) への変異体、Ser362 からAla (S362A) への変異体、または二重変異体 (T359A/S362A)、またp90RSKファミリーメンバーであるRSK2およびRSK3の野生型タンパク質を発現する細胞から調製されたライセートの調査に、本抗体を使用しました。
これらの結果は、トレオニン部位に対する特異性と、他のファミリーメンバー上の保存された部位を同等に検出する能力という、抗体の2つの重要な特徴を強調しています。これらの検証実験は、他社の大半においてほとんど行われていない、または軽視されています。
不均一戦略は、抗原標的の非天然的発現に依存するという点で他の特性からは顕著に異なるため、抗体の特異性と感度に関し意義のある知識を得るには、他の検証戦略と組み合わせることが大変重要です。不均一戦略は、単独で使用すると誤解を招くことがありますが、他の保証方法と組み合わせて使うと、非常に強力な抗体検証法となります。